题目内容
储氢纳米碳管研究成功体现了科技的进步.但用电弧法合成的碳纳米管常伴有大量的杂质--碳纳米颗粒.这种碳纳米颗粒可用氧化气化法提纯.其反应式为:
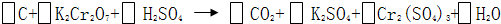
①配平上述反应,此反应的氧化剂是
②H2SO4在上述反应中表现出来的性质是
A.酸性 B.氧化性 C.吸水性 D.脱水性
由此可知上述反应所用硫酸应为
出碳单质与硫酸反应时的化学方程式:
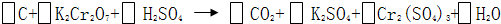
①配平上述反应,此反应的氧化剂是
K2Cr2O7
K2Cr2O7
,氧化产物是CO2
CO2
;当有1mol C完全反应时转移4
4
mol电子.②H2SO4在上述反应中表现出来的性质是
A
A
(填选项序号)A.酸性 B.氧化性 C.吸水性 D.脱水性
由此可知上述反应所用硫酸应为
稀
稀
(填“浓”或“稀”)硫酸.请写出碳单质与硫酸反应时的化学方程式:
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
.
| ||
分析:①反应中C元素的化合价由0升高为+4价,Cr元素的化合价由+6价降低为+3价,结合质量守恒定律以此配平,并计算转移的电子数;
②该反应中,硫酸中各元素的化合价不发生变化,反应中生成硫酸盐,而浓硫酸具有强氧化性,单质C与浓硫酸反应生成二氧化碳、二氧化硫、水.
②该反应中,硫酸中各元素的化合价不发生变化,反应中生成硫酸盐,而浓硫酸具有强氧化性,单质C与浓硫酸反应生成二氧化碳、二氧化硫、水.
解答:解:①反应中C元素的化合价由0升高为+4价,Cr元素的化合价由+6价降低为+3价,由电子守恒可知,C的化学计量数为3,K2Cr2O7的化学计量数为2,由质量守恒定律可知,配平后的化学反应为3C+2K2Cr2O7+8H2SO4=3CO2+2K2SO4+2Cr2(SO4)3+8H2O,Cr元素的化合价降低,则K2Cr2O7为氧化剂,C元素的化合价升高,则CO2为氧化产物,1molC参加反应转移电子为1mol×(4-0)=4mol,
故答案为:3C+2K2Cr2O7+8H2SO4=3CO2+2K2SO4+2Cr2(SO4)3+8H2O;K2Cr2O7;CO2;4;
②该反应中,硫酸中各元素的化合价不发生变化,反应中生成硫酸盐,则硫酸在该反应中作酸,体现酸性,应选A,而浓硫酸具有强氧化性,则上述反应的硫酸为稀硫酸,单质C与浓硫酸反应生成二氧化碳、二氧化硫、水,该反应为
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
故答案为:A;稀;C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O.
故答案为:3C+2K2Cr2O7+8H2SO4=3CO2+2K2SO4+2Cr2(SO4)3+8H2O;K2Cr2O7;CO2;4;
②该反应中,硫酸中各元素的化合价不发生变化,反应中生成硫酸盐,则硫酸在该反应中作酸,体现酸性,应选A,而浓硫酸具有强氧化性,则上述反应的硫酸为稀硫酸,单质C与浓硫酸反应生成二氧化碳、二氧化硫、水,该反应为
C+2H2SO4(浓)
| ||
故答案为:A;稀;C+2H2SO4(浓)
| ||
点评:本题考查氧化还原反应,明确常见元素的化合价及反应中元素的化合价变化是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应,式为:
C + K2Cr2O7 + H2SO4→ CO2 + Cr2(SO4)3+ K2SO4 + H2O
(1)完成并配平上述反应的化学方程式并标出电子转移方向与数目;
(2)此反应的氧化剂是 ,氧化产物是 ;
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
| A.酸性 | B.氧化性 | C.吸水性 | D.脱水性 |
 物质的量是 mol。
物质的量是 mol。