题目内容
常温下,有四种溶液:
下列说法不正确的是
A.①稀释到原来的10倍后,pH与④相同
B.由水电离出的c(OH-):①>③
C.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:
c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.①与③混合,若溶液pH = 7,则两溶液体积关系为:V(NaOH)=V(CH3COOH)
| ① | ② | ③ | ④ |
| 0.1mol/L CH3COOH溶液 | pH = 12 NaOH溶液 | 0.1mol/L NaOH溶液 | pH = 2 CH3COOH溶液 |
A.①稀释到原来的10倍后,pH与④相同
B.由水电离出的c(OH-):①>③
C.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:
c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.①与③混合,若溶液pH = 7,则两溶液体积关系为:V(NaOH)=V(CH3COOH)
AD
A不正确,若CH3COOH溶液为强酸,则0.1mol/L溶液中pH =1,稀释到原来的10倍后pH = 2,而实际上CH3COOH溶液为弱酸不可能与④相同;
B正确,pH = 12的NaOH溶液,由水电离出的c(OH-)=10—12mol/L;0.1mol/L 的NaOH溶液,由水电离出的c(OH-)=10—13mol/L;
C正确,②与④混合溶液中的氢离子与氢氧根离子恰好完全反应,但是CH3COOH溶液为弱酸溶液,随反应的进行会电离出氢离子使溶液显酸性,溶液中离子浓度大小关系为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-);
D不正确,①与③混合,若溶液pH = 7,则CH3COOH溶液的体积必须大于NaOH溶液体积才可能呈中性。
B正确,pH = 12的NaOH溶液,由水电离出的c(OH-)=10—12mol/L;0.1mol/L 的NaOH溶液,由水电离出的c(OH-)=10—13mol/L;
C正确,②与④混合溶液中的氢离子与氢氧根离子恰好完全反应,但是CH3COOH溶液为弱酸溶液,随反应的进行会电离出氢离子使溶液显酸性,溶液中离子浓度大小关系为:c(CH3COO-)>c(H+)>c(Na+)>c(OH-);
D不正确,①与③混合,若溶液pH = 7,则CH3COOH溶液的体积必须大于NaOH溶液体积才可能呈中性。

练习册系列答案
相关题目
 g(OH)2沉淀,说明MgCO3的溶解度小于Mg(OH)2
g(OH)2沉淀,说明MgCO3的溶解度小于Mg(OH)2 烧杯中滴加FeCl3饱和溶液并长时间煮沸
烧杯中滴加FeCl3饱和溶液并长时间煮沸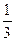 y,则x值为
y,则x值为