题目内容
【题目】自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石(Na3AlF6)等
(1)基态氟原子中,有_______种能量不同的电子。
(2)萤石(CaF2)难溶于水,但可溶于含Al3+的溶液中,原因是_________________(用离子方程式表示)。(已知AlF63-在溶液中可稳定存在)
(3)BF3与一定量的水形成(H2O)2BF3晶体Q,晶体Q在一定条件下可转化为R:
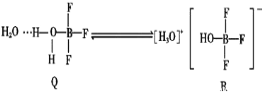
①晶体R中含有的化学键包括_________(填标号)。
A.离子键 B.配位键 C.共价键 D.氢键
②R中阳离子的空间构型为_________,阴离子中心原子的杂化方式为_________。
(4)F2与其他卤素单质反应可以形成卤素互化物,如ClF3、BrF3等。ClF3的熔沸点比BrF3的低,原因是___________________________________。
(5)Na3AlF6晶胞结构如图所示:
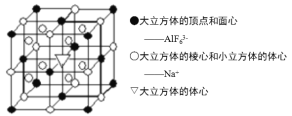
①位于大立方体体心▽代表________(填离子符号);
②AlF63-做面心立方最密堆积形成正四面体和正八面体两种空隙,正四面体空隙数和AlF63-数之比为_______,其中_________%正八面体空隙被Na+填充;
③晶胞边长为x nm,则相距最近的两个Na+之间距离为_____ nm;设Na3AlF6的相对分子质量为M,阿伏加德罗常数为NA,则该晶体密度的计算表达式为________g/cm3。
【答案】3 3CaF2+Al3+=3Ca2++AlF63- ABC 三角锥形 sp3 ClF3相对分子质量较小,分子间范德华力较弱,故熔沸点较低 Na+ 8:4或2:1 100 ![]()
![]()
【解析】
(1)根据F原子的核外电子排布式判断电子的种类数目;
(2) F-与Al3+能形成很难电离的配离子AlF63-;
(3)①非金属元素原子之间易形成共价键,含有空轨道的原子和含有孤电子对的原子之间易形成配位键,分子之间存在范德华力,水分子中的O原子和其它分子中连在N、O、F上的H原子易形成氢键;②根据价层电子对互斥理论确定H3O+空间构型、阴离子中中心原子杂化方式;
(4)结构相似的物质,相对分子质量越大,分子晶体的熔沸点越高;
(5)①利用均摊法确定化学式,可确定晶胞中心的微粒是哪种微粒;
②根据晶体结构确定含有的正四面体数目,结合含有的AlF63-的数目确定二者比例关系;根据Na+在晶胞中位置确定Na+填充的百分比;
③晶胞边长为xnm,相距最近的两个Na+在晶胞体对角线的![]() 处;利用一个晶胞中含有的Na3AlF6的数目,结合
处;利用一个晶胞中含有的Na3AlF6的数目,结合![]() 计算晶胞的密度。
计算晶胞的密度。
(1)F是9号元素,核外电子排布式是1s22s22p5,可知其核外有3种不同能量的电子;
(2)萤石(CaF2)难溶于水,但可溶于含Al3+的溶液中,原因是在溶液中F-与Al3+能形成很难电离的配离子AlF63-,使CaF2的溶解平衡正向移动,最终完全溶解,反应的离子方程式为:3CaF2+Al3+=3Ca2++AlF63-;
(3)①晶体R是离子晶体,含有离子键;B与F及水分子内的H与O等非金属元素原子之间易形成共价键,B原子含有空轨道、O原子含有孤电子对,所以B原子和O原子之间存在配位键,分子之间存在范德华力,水分子中的O原子和其它分子中的连在N、O、F上的H原子易形成氢键,但是氢键不属于化学键,属于含有的化学键类型有离子键、共价键、配位键,故合理选项是ABC;
②H3O+中O原子价层电子对个数=3+![]() =4,且O原子上含有一个孤电子对,所以为三角锥形结构;阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式;
=4,且O原子上含有一个孤电子对,所以为三角锥形结构;阴离子中中心原子B原子含有4个σ键且不含孤电子对,所以B原子采用sp3杂化方式;
(4)由于结构相似的物质,相对分子质量越大,分子晶体的熔沸点越高,ClF3、BrF3结构相似,ClF3的相对分子质量比BrF3的小,所以ClF3的熔、沸点比BrF3的低;
(1)①在已经确定位置的微粒结构中含AlF63-的个数是:![]() ,含有Na+数目为
,含有Na+数目为![]() =11,由于Na3AlF6晶胞中Na+与AlF63-的个数比为3:1,所以在晶胞中心含有的微粒是Na+;
=11,由于Na3AlF6晶胞中Na+与AlF63-的个数比为3:1,所以在晶胞中心含有的微粒是Na+;
②由晶胞结构可知:在该晶体中含有的AlF63-作面心立方最密堆积,形成的正四面体数目是8个,由于在一个晶胞中含有4个AlF63-,所以二者的比是8:4=2:1;Na+位于6个面心AlF63-形成的正八面体中心,所以100%正八面体空隙被Na+填充;
③晶胞边长为xnm,在该晶体中两个最近的Na+位置在晶胞立方体对角线的![]() 处;由于晶胞边长为xnm,所以立方体对角线为
处;由于晶胞边长为xnm,所以立方体对角线为![]() nm,则相距最近的两个Na+之间距离为
nm,则相距最近的两个Na+之间距离为![]() nm;根据①的计算可知:在一个晶胞中含有4个Na3AlF6,则该晶胞的密度
nm;根据①的计算可知:在一个晶胞中含有4个Na3AlF6,则该晶胞的密度 =
=![]() g/cm3。
g/cm3。

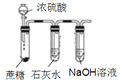
【题目】下列装置能达到实验目的的是
选项 | A | B | C | D |
实验装置 |
|
|
|
|
实验目的 | 探究Na2CO3和NaHCO3溶解度的相对大小 | 用已知浓度的NaOH溶液滴定未知浓度的稀硫酸 | 检验蔗糖与浓硫酸反应产生的CO2 | 验证镁和稀盐酸的反应的热效应 |
A. A B. B C. C D. D