题目内容
A.C(s)+![]() O2(g)
O2(g)![]() CO(g)ΔH=-393.5 kJ·mol-1
CO(g)ΔH=-393.5 kJ·mol-1
B.2H2(g)+O2(g)![]() 2H2O(g)ΔH=+571.6 kJ·mol-1
2H2O(g)ΔH=+571.6 kJ·mol-1
C.CH4(g)+2O2(g)![]() CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1
CO2(g)+2H2O(g)ΔH=-890.3 kJ·mol-1
D.![]() C6H12O6(s)+3O2(g)
C6H12O6(s)+3O2(g)![]() 3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
解析:根据燃烧热的定义,碳完全燃烧应是生成稳定化合物CO2,而不是CO,故A错;B中ΔH=-571.6 kJ·mol-1,C中应生成液态水与-890.3 kJ·mol-1相对应,故A、B、C都错,应选D。
答案:D

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
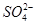 (aq)+
(aq)+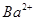 (aq)+2
(aq)+2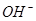 (aq) = BaSO4(s)+2H
(aq) = BaSO4(s)+2H O(l);
O(l); H =
H =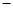 57.3 kJ/mol
57.3 kJ/mol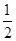 H
H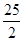 O
O 57.3 kJ/mol
57.3 kJ/mol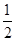 H2 SO4(aq)=
H2 SO4(aq)=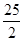 O2(g)=8CO2(g)+9H2O △H=
O2(g)=8CO2(g)+9H2O △H= (aq)+
(aq)+ (aq)+2OH
(aq)+2OH (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H O(1);
O(1);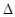 H=
H=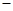 57.3
kJ/mol
57.3
kJ/mol B.KOH(aq)+
B.KOH(aq)+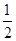 H
H O(I);
O(I);  O
O