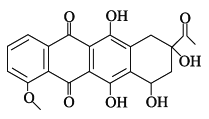
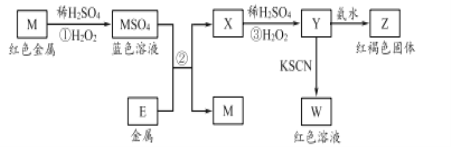
��Ŀ����
����Ŀ���ѻӷ��Զ�������TaS2 ���ɲ�������װ���ᴿ����������TaS2 ��ĩװ��ʯӢ��һ�ˣ�����պ����������Ⲣ��ܣ����ڼ���¯�С���Ӧ���£�
TaS2��g��+2I2��g��![]() TaI4��g��+S2��g��
TaI4��g��+S2��g��
����˵����ȷ���� �� ��
A���ڲ�ͬ�¶�����TaI4 �������ֲ���
B�����ᴿ�����У�I2 �������ϼ���
C�����ᴿ�����У�I2�������ǽ�TaS2 �Ӹ�����ת�Ƶ�������
D��������Ӧ��ƽ�ⳣ����TaI4 ��S2 ��Ũ�ȳ˻��ɷ���
���𰸡�C
��������
������������ݷ���ʽ��������TaI4�����ߣ�������TaI4 ����С����A�������ᴿ�����У�I2 ������������B����TaS2�ѻӷ������ᴿ�����У�I2�������ǽ�TaS2 �Ӹ�����ת�Ƶ�����������C��ȷ��������Ӧ��ƽ�ⳣ����TaI4 ��S2 ��Ũ�ȳ˻�����������D������

����Ŀ�����������CO����ϳɼ״�(CH3OH)����ȩ(CH3CHO)���Ҵ���̼�ĺ����������ǽ�������ѧ��Ƚϻ�Ծ���о�����֮һ��
��1����֪��������CO(g)+2H2(g)![]() CH3OH(g) ��H1=-90.1kJ/mol
CH3OH(g) ��H1=-90.1kJ/mol
������2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ��H2=-24.5kJ/mol
CH3OCH3(g)+H2O(g) ��H2=-24.5kJ/mol
������C2H5OH(g)![]() CH3OCH3(g) ��H3=+50.7kJ/mol
CH3OCH3(g) ��H3=+50.7kJ/mol
����CO�������Ʊ��Ҵ�����(��һ����Ϊˮ����)���Ȼ�ѧ��Ӧ����ʽΪ________��
��2��ֱ�Ӽ״�ȼ�ϵ��(DMFC)�ɱ��͡�Ч�ʸߣ�ij�о���������DMFC���������Ʒ�ˮ�����ڷ�ˮpHl0~12.5���������У�CN���ȱ�������CNO��(���������е�Ԫ�ؾ�Ϊ-3��)���ٽ�һ������Ϊ̼���κ�N2��
����д��CNO���������ĵ缫��Ӧʽ________��
��������1m3CN������Ϊ390mg/L�ĵ�Ʒ�ˮ����������________kg�״���
��3����2.0L�ܱ������з���1 molCO��2molH2���ڷ�Ӧ�¶�T1ʱ�������·�Ӧ��
CO(g)+2H2(g)=CH3OH(g)����Ӧʱ��(t)�����������������ʵ���(n)�����ݼ��±���
ʱ��t/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
�����ʵ���n/mol | 3.0 | 2.7 | 2.5 | 2.3 | 2.1 | 2.0 | 2.0 |
����0~5minʱ�Σ���Ӧ����v(CH3OH)Ϊ________�����������������Ӧƽ��ת���ʵ�������________��
A.���¸�ѹ B.���µ�ѹ C.���µ�ѹ D.���¸�ѹ
�ڼ����¶�T1ʱ��Ӧ��ƽ�ⳣ��K1________��T1ʱ��ƽ��ı䷴Ӧ�¶�ΪT2��ƽ�ⳣ��������T2________T1(������������С����)���ж�������________��