��Ŀ����
����Ŀ����ͼ��ʵ�����Ʊ�����������һϵ�����ʵ���װ�ã��г��豸���ԣ���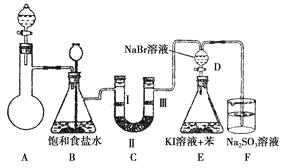
��1���Ʊ�����ѡ�õ�ҩƷΪƯ�۾������Ũ���ᣬ��ط�Ӧ�Ļ�ѧ����ʽΪ�� ��
��2��װ��B�б���ʳ��ˮ����������
ͬʱװ��B���ǰ�ȫƿ�����ʵ�����ʱC���Ƿ�����������д����������ʱB�е�������
��3��װ��C��ʵ��Ŀ������֤�����Ƿ����Ư���ԣ�Ϊ��C�Т����η������ʵ�����������ţ���
��� | a | b | c | d |
�� | �������ɫ���� | �������ɫ���� | ʪ�����ɫ���� | ʪ�����ɫ���� |
�� | ��ʯ�� | �轺 | Ũ���� | ��ˮ�Ȼ��� |
�� | ʪ�����ɫ���� | ʪ�����ɫ���� | �������ɫ������ | �������ɫ���� |
��4�����װ��D��E��Ŀ���DZȽ��ȡ��塢��ķǽ����ԡ���Ӧһ��ʱ���������װ��D��������Һ����װ��E�У����۲쵽��������������������ܡ����ܡ���˵����ķǽ�����ǿ�ڵ⣬ԭ������
��5�����������װ��F�пɸ���������NaHSO3��Һ�������ȣ���д����Ӧ�����ӷ�Ӧ����ʽ����
���жϸ���NaHSO3��Һ�Ƿ���У�����ǡ�����
���𰸡�
��1��Ca��ClO��2��4HCl��Ũ��===CaCl2��2Cl2����2H2O
��2����ȥCl2�е�HCl��װ��B�г���©����Һ���������γ�һ��ˮ��
��3��d
��4��E����Һ��Ϊ���㣬�ϲ㣨���㣩Ϊ�Ϻ�ɫ�����ܣ�������Cl2Ҳ�ɽ�I������ΪI2
��5��HSO3-��Cl2��H2O===SO42-��2Cl����3H������4HSO3-��Cl2===SO42-��2Cl����3SO2��2H2O������
�������� ��1��Ư�۾��������Ҫ�ɷ�ΪCa��ClO��2��CaCl2 �� ����Ca��ClO��2����Ũ������ȡ��������Ӧ�Ļ�ѧ����ʽΪCa��ClO��2��4HCl��Ũ��===CaCl2��2Cl2����2H2O����3��������ˮ��Ӧ���ɵ�HClO����Ư���ԣ������������û��Ư���ԣ�ͨ��װ��B�������к���ˮ�����������ͨ��ʪ�����ɫ��������ͨ������װ�ã�ѡ���������������ͨ���������ɫ��������5��HSO3-���л�ԭ�ԣ�������Cl2����������ԭ��Ӧ�����ܲ���SO2 �� ��Ⱦ��������˸÷��������С�

 �ظ���ʦ�㲦ϵ�д�
�ظ���ʦ�㲦ϵ�д�