题目内容
【题目】
有机物H为某种工人合成纤维的单体,其合成路线如下:

已知:F的核磁共振氢谱有四个峰,峰的面积比为1:1:3:3.
回答下列问题:
(1)A的名称为_______;C中官能团的名称为_______。
(2)G+F→H的反应类型为_______;H的结构简式为_______。
(3)C→D的化学方程式为_______。
(4)E在一定条件下生成的高分子化合物的结构简式为:_________。
(5)X是F的同分异构体,它同时符合下列3个条件:
①能发生加聚反应 ②能发生水解反应 ③能发生银镜反应
则X的结构(不包括立体异构)有______种。
【答案】 2甲基1丁烯 羟基、醛基 酯化反应(或取代的反应) CH3CH=C(CH3)COOCH2CH3 CH3CH2![]() CHO+2Cu(OH)2+NaOH
CHO+2Cu(OH)2+NaOH![]() CH3CH2
CH3CH2![]() COONa+Cu2O↓+3H2O
COONa+Cu2O↓+3H2O 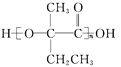 8
8
【解析】A与溴水发生加成反应,根据生成物结构简式可知A的结构简式为,CH3CH2C(CH3)=CH2;卤代烃水解生成B,则B的结构简式为CH3CH2C(CH3)OHCH2OH;B发生催化氧化反应生成C,则C的结构简式为CH3CH2C(CH3)OHCHO;C与新制氢氧化铜悬浊液发生氧化反应并酸化醛基转化为羧基,则E的结构简式为CH3CH2C(CH3)OHCOOH;E在浓硫酸的作用下发生消去反应生成F,则F的结构简式为CH3CH=C(CH3)COOH;溴乙烷水解生成G是乙醇,乙醇与F发生酯化反应生成H,则H的结构简式为CH3CH=C(CH3)COOCH2CH3;
(1)根据以上分析可知A的名称为2甲基1丁烯;C中官能团的名称为羟基、醛基。(2)G+F→H的反应类型为酯化反应(或取代的反应);H的结构简式为CH3CH=C(CH3)COOCH2CH3。(3)C→D的化学方程式为CH3CH2![]() CHO+2Cu(OH)2+NaOH
CHO+2Cu(OH)2+NaOH![]() CH3CH2
CH3CH2![]() COONa+Cu2O↓+3H2O。(4)E分子含有羟基和羧基,在一定条件下发生缩聚反应生成的高分子化合物的结构简式为
COONa+Cu2O↓+3H2O。(4)E分子含有羟基和羧基,在一定条件下发生缩聚反应生成的高分子化合物的结构简式为 。(5)①能发生加聚反应,含有碳碳双键;②能发生水解反应,含有酯基;③能发生银镜反应,说明是甲酸形成的酯基,符合条件的有机物结构简式为HCOOCH2CH2CH=CH2、HCOOCH2CH=CHCH3、HCOOCH=CHCH2CH3、HCOOCH(CH3)CH=CH2、HCOOCH2C(CH3)=CH2、HCOOC(CH3)=CHCH3、HCOOCH=C(CH3)2、HCOOC(C2H5)=CH2,因此共计是8种。
。(5)①能发生加聚反应,含有碳碳双键;②能发生水解反应,含有酯基;③能发生银镜反应,说明是甲酸形成的酯基,符合条件的有机物结构简式为HCOOCH2CH2CH=CH2、HCOOCH2CH=CHCH3、HCOOCH=CHCH2CH3、HCOOCH(CH3)CH=CH2、HCOOCH2C(CH3)=CH2、HCOOC(CH3)=CHCH3、HCOOCH=C(CH3)2、HCOOC(C2H5)=CH2,因此共计是8种。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氰化钠(NaCN)是一种重要的化工原料,用于电镀、冶金和有机合成医药,农药及金属处理等方面。
已知:氰化钠为白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味,剧毒。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性。
(1)氰化钠中氮元素的化合价是______,用离子方程式表示NaCN溶液呈强碱性的原因:________。
(2)已知:
物质 | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=6.2×10-10 | Ka1=4.5×10-7,Ka2=4.7×10-11, |
则向NaCN溶液通入少量CO2反应的离子方程式:_______________。
(3)用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法错误的是________________。

A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
C.阴极的电极反应式为:2H2O+2e- =H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+ =N2↑+2CO2↑+5Cl-+H2O
(4)氰化钠可用双氧水进行消毒处理。
用双氧水处理氰化钠产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式____________;
(5)过碳酸钠(2Na2CO3·3H2O2)具有Na2CO3和H2O2的双重性质,也可用于含氰废水的消毒处理。
① 下列物质中,不会引起过碳酸钠发生氧化还原反应的有___________。
A. FeC13 B. CuSO4 C. Na2SiO3 D. KCN
② 已知 6KMnO4 + 5(2Na2CO3·3H2O2)+19H2SO4=3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O.现称取0.2000g 过碳酸钠样品于250mL 锥形瓶中,加50mL蒸溜水溶解,再加50mL 2.0000molL-1H2SO4,用0.0200 molL-1 KMnO4标准溶液滴定至终点时消耗30.00mL,则产品中H2O2的质量分数为______。






