题目内容
氢、碳、氧、硫是自然界极为丰富的非金属元素,它们构成了许许多多的化合物.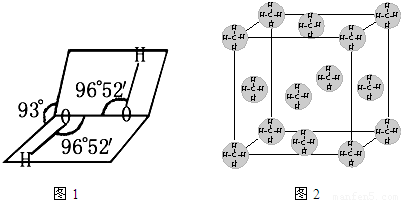
(1)H、O、S电负性由大到小的顺序是______.
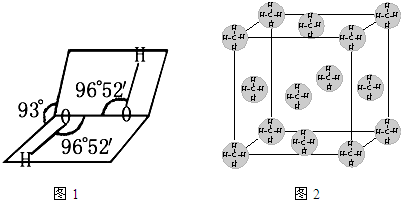
(2)如图1是H2O2的空间构型,H2O2中每个氧都是______杂化.
(3)H2S和H2O2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 水中溶解度(标况) | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(4)甲烷晶体的晶胞如图2所示,此晶体在常温、常压下不能存在的原因______.
【答案】分析:(1)同一周期中,元素的电负性随着原子序数的增大而增大,同一主族,元素的电负性随着原子序数的增大而减小,非金属性越强的元素其电负性越大;
(2)根据价层电子对互斥理论确定;
(3)氢键影响物质的沸点和溶解性,含有氢键的物质沸点较高、溶解性较强;
(4)根据晶体类型判断.
解答:解:(1)同一周期中,元素的电负性随着原子序数的增大而增大,同一主族,元素的电负性随着原子序数的增大而减小,非金属性越强的元素其电负性越大,这三种元素中,非金属性最强的是O,其次是S,最小的是H,所以H、O、S电负性由大到小的顺序是O>S>H,故答案为:O>S>H;
(2)根据其图象知,双氧水分子是每个氧原子含有2个共用电子对且含有2个孤电子对,所以其价层电子对数是4,氧原子采用sp3杂化,故答案为:sp3;
(3)O元素非金属性较强,对应的氢化物能形成氢键,且与水分子之间也可以形成氢键,硫元素和水分子间不能形成氢键,所以H2O2的沸点比H2S高,
故答案为:H2O2分子间存在氢键,与水分子可形成氢键;
(4)根据图象知,甲烷分子间靠分子间作用力结合,所以甲烷晶体为分子晶体,而防止晶体熔沸点在常压下很低,且甲烷的相对分子质量很小,分子间作用力很小,所以在常温常压下甲烷以气体形式存在而不能以形成晶体,
故答案为:甲烷分子间靠分子间作用力结合,所以甲烷晶体为分子晶体,而防止晶体熔沸点在常压下很低,且甲烷的相对分子质量很小,分子间作用力很小.
点评:本题考查了化学键、晶体类型、电负性大小等知识点,难度不大,根据元素周期律、晶体与熔沸点的关系分析解答.
(2)根据价层电子对互斥理论确定;
(3)氢键影响物质的沸点和溶解性,含有氢键的物质沸点较高、溶解性较强;
(4)根据晶体类型判断.
解答:解:(1)同一周期中,元素的电负性随着原子序数的增大而增大,同一主族,元素的电负性随着原子序数的增大而减小,非金属性越强的元素其电负性越大,这三种元素中,非金属性最强的是O,其次是S,最小的是H,所以H、O、S电负性由大到小的顺序是O>S>H,故答案为:O>S>H;
(2)根据其图象知,双氧水分子是每个氧原子含有2个共用电子对且含有2个孤电子对,所以其价层电子对数是4,氧原子采用sp3杂化,故答案为:sp3;
(3)O元素非金属性较强,对应的氢化物能形成氢键,且与水分子之间也可以形成氢键,硫元素和水分子间不能形成氢键,所以H2O2的沸点比H2S高,
故答案为:H2O2分子间存在氢键,与水分子可形成氢键;
(4)根据图象知,甲烷分子间靠分子间作用力结合,所以甲烷晶体为分子晶体,而防止晶体熔沸点在常压下很低,且甲烷的相对分子质量很小,分子间作用力很小,所以在常温常压下甲烷以气体形式存在而不能以形成晶体,
故答案为:甲烷分子间靠分子间作用力结合,所以甲烷晶体为分子晶体,而防止晶体熔沸点在常压下很低,且甲烷的相对分子质量很小,分子间作用力很小.
点评:本题考查了化学键、晶体类型、电负性大小等知识点,难度不大,根据元素周期律、晶体与熔沸点的关系分析解答.

练习册系列答案
相关题目
阅读下面的信息,推断元素及有关物质,按要求回答问题:
信 息 | 问 题 |
①X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2 | (1)根据信息①,X一定不是____________(填序号)。 A.氢 B.碳 C.氧 D.硫 |
②上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26 | (2)这四种元素中是否可能有一种是铝元素?(填“可能”或“不可能”)____________ |
③向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀 | (3)白色沉淀物的化学式为: _____________________________ _____________________________ |
④向上述四种元素单质组成的混合物中加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀 | (4)生成白色沉淀的离子方程式为:_____ ______________________________________ |
⑤X与W同主族 | (5)X与浓硫酸反应的化学方程式为:___ ______________________________________ |