题目内容
(1)25℃时,纯水中[H+]·[OH-]=10-14,pH=7.温度升高时水的离子积常数KW=1×10-12,此时纯水pH=________,因为H2O![]() H++OH-是________热反应.
H++OH-是________热反应.
(2)在一定温度下,某盐酸溶液中[H+]=1×10-6mol·L-1,若用水稀释10倍时,溶液pH________7(填“>”,“<”或“=”).
(3)某溶液的pH由12降到10时,溶液中[H+]是原来的________倍.
(4)25℃时,取10mL 0.1mol·L-1的盐酸与20mL 0.1mol·L-1的氢氧化钠溶液混合后,混合溶液的pH=________.
答案:
解析:
解析:
|
(1)6,吸;(2)<;(3)100;(4)13-lg3 导解:盐酸溶液稀释10倍,仍然是酸性溶液.由于是极稀盐酸溶液,此时水的电离就应该考虑.(4)中,由于混合后碱过量,故应求c(OH-).c(OH-)= c(H+)= 故pH=13-lg3. |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
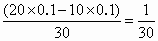 mol·L-1,
mol·L-1,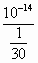 =3×10-13mol/L,
=3×10-13mol/L,