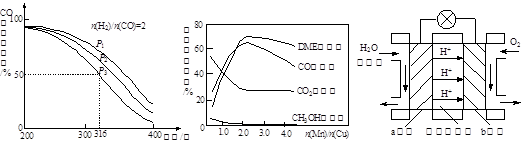题目内容
在298 K、1.01×105 Pa下,将32 g SO2通入750 mL 1 mol/L KOH溶液中充分反应。测得反应放出x kJ的热量。已知在该条件下,1 mol SO2通入1 L 2 mol/L KOH溶液中充分反应放出y kJ的热量。则SO2与KOH溶液反应生成KHSO3的热化学方程式正确的是( )
| A.SO2(g)+KOH(aq)=KHSO3(aq)ΔH="-(4x-y)" kJ/mol |
| B.SO2(g)+KOH(aq)=KHSO3(aq)ΔH="-(2x-y)" kJ/mol |
| C.SO2(g)+KOH(aq)=KHSO3(aq)ΔH="-(2y-x)" kJ/mol |
| D.2SO2(g)+2KOH(l)=2KHSO3(l)ΔH="-(8x-2y)" kJ/mol |
A
1 mol SO2通入1 L 2 mol/L KOH溶液中,生成1 mol K2SO3,放出y kJ的热量,由此可得SO2(g)+2KOH(aq)=K2SO3(aq)+H2O(l) ΔH="-y" kJ/mol。32 g SO2通入750 mL 1 mol/L KOH溶液中充分反应,生成K2SO3、KHSO3各0.25 mol,测得反应放出x kJ的热量,故生成0.25 mol KHSO3放出(x-0.25y)kJ的热量,所以生成1 mol KHSO3放出(4x-y)kJ的热量,A正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CO2(g) ΔH1<0①
CO2(g) ΔH1<0① CH3OH(g)。
CH3OH(g)。 O2(g)=H2O(g) ΔH=-241.8 kJ/mol。
O2(g)=H2O(g) ΔH=-241.8 kJ/mol。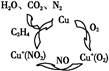
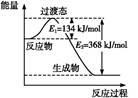
 O2(g)=CO2(g)+2H2(g)ΔH="-192.9" kJ·mol-1。
O2(g)=CO2(g)+2H2(g)ΔH="-192.9" kJ·mol-1。
 HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g) △H=-34kJ/mol
 O2(g)=CO2(g) ΔH2=b kJ·mol-1
O2(g)=CO2(g) ΔH2=b kJ·mol-1 2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中
2NH3(g) ΔH=-92.4 kJ·mol-1,开始他们将N2和H2混合气体20 mol(体积比1∶1)充入5 L合成塔中,反应前压强为P0,反应过程中压强用P表示,反应过程中 与时间t的关系如图所示。
与时间t的关系如图所示。
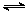 CH3OH(g) △H 1=-90.7 kJ·mol-1
CH3OH(g) △H 1=-90.7 kJ·mol-1