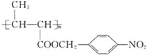
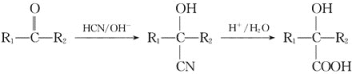
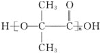
题目内容
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时即产生N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
(1)写出该反应的热化学方程式____。
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是__。
(3)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
则2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g) ΔH3=____kJ·mol-1
(4)用离子方程式表示碳酸钠溶液显碱性的原因:________。
【答案】N2H4(g)+ 2H2O2(l)= N2(g) + 4H2O(g)△H=-640 kJ/mol 生成物是氮气和水,不污染空气 -130.8 CO32-+H2OHCO3-+OH-
【解析】
(1) 已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量,据此写出该反应的热化学方程式;
(2)还有一个很突出的优点从对环境友好的角度回答;
(3)应用盖斯定律求算2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g) ΔH3;
(4)碳酸钠溶液水解呈显碱性,据此写离子方程式;
(1) 设N2H4(g)+ 2H2O2(l)= N2(g) + 4H2O(g)△H=-Q kJ/mol,已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量,则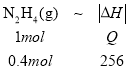 ,则Q=640,故该反应的热化学方程式为N2H4(g)+ 2H2O2(l)= N2(g) + 4H2O(g)△H=-640 kJ/mol;
,则Q=640,故该反应的热化学方程式为N2H4(g)+ 2H2O2(l)= N2(g) + 4H2O(g)△H=-640 kJ/mol;
答案为:N2H4(g)+ 2H2O2(l)= N2(g) + 4H2O(g)△H=-640 kJ/mol;
(2) 上述反应应用于火箭推进剂,还有一个很突出的优点从对环境友好的角度回答则是:生成物是氮气和水,不污染空气;
答案为:生成物是氮气和水,不污染空气;
(3) 反应①CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1,反应②为:CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1,按盖斯定律:2×①-②得2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g),则ΔH3=2×ΔH1-ΔH2=-130.8 kJ·mol-1;
答案为:-130.8;
(4)碳酸钠溶液水解呈显碱性,则离子方程式为:CO32-+H2OHCO3-+OH-;
答案为:CO32-+H2OHCO3-+OH-。

【题目】(1)某元素原子共有3个价电子,其中一个价电子位于第三能层![]() 能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
(2)![]() 、
、![]() 均为短周期金属元素。依据下表数据,写出
均为短周期金属元素。依据下表数据,写出![]() 原子的核外电子排布式:______。
原子的核外电子排布式:______。
电离能/ |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |