题目内容
7.相同条件下,把11体积H2、5体积O2和1体积Cl2组成混合气体在密闭容器中引燃,恰好完全反应,所得盐酸的质量分数为28.9%.分析 相同条件下气体摩尔体积相等,11体积H2、5体积O2和1体积Cl2的物质的量之比等于其体积之比=11:5:1,在密闭容器中引燃,发生的化学反应为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,根据方程式知,1体积氯气完全反应需要1体积氢气,剩余的10体积氢气和5体积氧气恰好反应生成水,生成的HCl溶于水得到盐酸溶液,设氢气、氧气、氯气的物质的量分别是11mol、5mol、1mol,生成的HCl的物质的量为2mol,则m(HCl)=2mol×36.5g/mol=73g,根据质量守恒定律知,盐酸溶液质量=m(H2)+m(O2)+m(Cl2)=11mol×2g/mol+5mol×32g/mol+1mol×71g/mol=253g,溶液质量分数=$\frac{溶质质量}{溶液质量}×100%$.
解答 解:相同条件下气体摩尔体积相等,11体积H2、5体积O2和1体积Cl2的物质的量之比等于其体积之比=11:5:1,在密闭容器中引燃,发生的化学反应为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O、Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl,根据方程式知,1体积氯气完全反应需要1体积氢气,剩余的10体积氢气和5体积氧气恰好反应生成水,生成的HCl溶于水得到盐酸溶液,设氢气、氧气、氯气的物质的量分别是11mol、5mol、1mol,生成的HCl的物质的量为2mol,则m(HCl)=2mol×36.5g/mol=73g,根据质量守恒定律知,盐酸溶液质量=m(H2)+m(O2)+m(Cl2)=11mol×2g/mol+5mol×32g/mol+1mol×71g/mol=253g,溶液质量分数=$\frac{溶质质量}{溶液质量}×100%$=$\frac{73g}{253g}×100%$=28.9%,
故答案为:28.9.
点评 本题考查化学方程式有关计算,为高频考点,明确方程式中各个物理量之间关系即可解答,结合方程式解答,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 原子半径D<C<B<A | B. | 原子序数 d>c>a>b | ||
| C. | 离子半径C>D>B>A | D. | 单质的氧化性C>D>A>B |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ⑩ | |||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑨ | |||
| 4 | ② | ④ |
 ,④离子的核外电子排布示意图
,④离子的核外电子排布示意图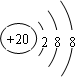 .
.⑦、⑨两种元素最高价氧化物对应水化物的化学式分别为:H3PO4、HClO4;
⑦元素气态氢化物的稳定性小于⑨元素气态氢化物的稳定性(填大于、等于或小于)
(2)失电子能力最强的单质与水反应的化学方程式是2K+2H2O=2KOH+H2↑
(3)写出③的单质置换出⑥的单质的化学方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
①和⑤两种元素最高价氧化物对应的水化物相互反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
| A. | 等体积、等浓度的Ca(HCO3)2 溶液和NaOH溶液混合:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O | |
| B. | NH4HCO3 溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| C. | 少量SO2通入苯酚钠溶液转:C6H5O-+SO2+H2O═C6H5OH+HSO3- | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2 +2H2O═Al(OH)3 ↓+HCO3- |
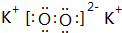 ;
;