题目内容
【题目】I、氨气催化氧化生产硝酸,硝酸厂常用催化还原法处理尾气:催化剂存在时用H2将NO2还原为N2。
已知:2 H2 ( g ) +O2 ( g )=2H2O ( g ) ΔH = -483.6 kJ/mol
N2 ( g ) +2O2 ( g )=2NO2 ( g ) ΔH = + 67.7 kJ/mol
则H2将NO2还原为N2的热化学反应方程式:___________________________
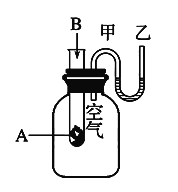
II、为了研究化学反应A+B===C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。试回答下列问题:
(1)该反应为_____(填“放热”或“吸热”)反应。ΔH___0(填>、<、=)
(2)A和B的总能量比C和D的总能量_____(填“高”或“低”)。
(3)物质中的______能通过化学反应转化成______能释放出来。
(4)反应物化学键断裂吸收的能量_____(填“高”或“低”)于生成物化学键形成放出的能量。
【答案】 4H2(g)+2NO2(g)=N2(g)+4H2O ( g ) ΔH =-1034.9 kJ/mol 放热 < 高 化学 热 低
【解析】试题分析:本题考查盖斯定律的应用,化学反应中的能量变化。
I.将两个热化学方程式编号:
2 H2 ( g ) +O2 ( g )=2H2O ( g ) ΔH = -483.6 kJ/mol(①式)
N2 ( g ) +2O2 ( g )=2NO2 ( g ) ΔH = + 67.7 kJ/mol(②式)
应用盖斯定律,将①式![]() 2-②式得,4H2(g)+2NO2(g)=N2(g)+4H2O(g)的ΔH=(-483.6kJ/mol)
2-②式得,4H2(g)+2NO2(g)=N2(g)+4H2O(g)的ΔH=(-483.6kJ/mol)![]() -(+67.7kJ/mol)=-1034.9kJ/mol,H2将NO2还原为N2的热化学反应方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-1034.9kJ/mol。
-(+67.7kJ/mol)=-1034.9kJ/mol,H2将NO2还原为N2的热化学反应方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g) ΔH=-1034.9kJ/mol。
II.(1)当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升,说明装置中的空气受热膨胀,则该反应是放热反应,ΔH![]() 0。
0。
(2)因为是放热反应,则A和B的总能量比C和D的总能量高。
(3)因为是放热反应,物质中的化学能通过化学反应转化成热能释放出来。
(4)因为是放热反应,则反应物化学键断裂吸收的能量低于生成物化学键形成放出的能量。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:C(s)+H2O(g) ![]() CO(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=________。
(2)该反应为________反应(填“吸热”或“放热”)。
(3)某温度下,各物质的平衡浓度符合下式:3c(H2O)=5c(CO)·c(H2),试判断此时的温度为______。
(4)830 ℃时,容器中的反应已达到平衡。在其他条件不变的情况下,扩大容器的体积。平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(5)已知可逆反应CO2(g)+H2(g) ![]() CO(g)+H2O (g), k=3.5,1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
CO(g)+H2O (g), k=3.5,1 200 ℃时,在某时刻平衡体系中CO2、H2、CO、H2O的浓度分别为2 mol·L-1、2 mol·L-1、4 mol·L-1、4 mol·L-1,则此时上述反应的平衡移动方向为____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性电极电解NaCl溶液:2Cl-+2H2O | 用惰性电极电解MgBr2溶液:2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性:H++OH-=H2O | 稀HNO3与Ba(OH)2溶液反应至中性:H++OH-=H2O |
A. A B. B C. C D. D