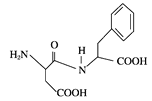
题目内容
【题目】下列反应的离子方程式正确的是( )
⑴ 浓盐酸与铁屑反应:2Fe + 6H+ == 2Fe3+ + 3H2↑
⑵ 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42- == 2BaSO4↓+Al(OH)3↓
⑶ 过量二氧化碳通入偏铝酸钠溶液中:AlO2- + CO2 + 2H2O == Al(OH)3↓ + HCO3-
⑷ 碳酸氢铵溶液与过量氢氧化钠溶液混合共热: NH4+ + HCO3- + 2OH- ![]() CO32- + NH3↑ + 2H2O
CO32- + NH3↑ + 2H2O
⑸ NaHCO3溶液与稀H2SO4反应:CO32- + 2H+ == H2O + CO2↑
⑹ MnO2 与浓盐酸反应制Cl2:MnO2 + 4HCl == Mn2++ 2Cl-+ Cl2↑+ 2H2O
⑺ 明矾溶于水产生Al(OH)3 胶体:Al3++3H2O == Al(OH)3↓+ 3H+
⑻ Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3- + Ca2+ + OH-== CaCO3↓+ H2O
⑼ 苯酚钠溶液中通入少量CO2:CO2 + H2O + 2C6H5Oˉ → 2C6H5OH + CO32ˉ
⑽ Fe(NO3)3 溶液中加入过量 HI 溶液: 2Fe3+ + 2I-== 2Fe2+ + I2
A. ⑵⑶⑷⑹ B. ⑶⑷⑸⑻⑽ C. ⑶⑷⑻ D. ⑴⑶⑷⑺⑻⑼
【答案】C
【解析】(1)浓盐酸与铁屑反应生成氯化亚铁和氢气;
(2) 使SO42-恰好完全沉淀,反应生成硫酸钡、偏铝酸钾、水;
(3)偏铝酸钠溶于通入二氧化碳生成氢氧化铝,氢氧化铝不溶于弱酸,二氧化碳过量生成碳酸氢根;
(4)过量的OH-和NH4+、HCO3-分别发生反应;
(5) 碳酸氢根离子保留整体;
(6) 该反应需要加热,浓盐酸中的HCl在离子方程式中需要拆开;
(7) 水解为可逆反应,且生成胶体,不是沉淀,则明矾溶于水产生Al(OH)3胶体;
(8)少量NaOH溶液完全反应,生成碳酸钙、水、碳酸氢钠;
(9) 苯酚酸性大于碳酸氢根离子,苯酚钠溶液与少量二氧化碳反应生成苯酚和碳酸氢钠;
(10) 硝酸根在酸性条件下具有强氧化性;且氧化性大于Fe3+;故不符合反应事实,应为碘离子与硝酸得反应;
(1)浓盐酸与铁屑反应的离子反应为Fe+2H+═Fe2++H2↑,故(1)错误;
(2) 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀的离子反应为2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故(2)错误;
(3)过量二氧化碳通入偏铝酸钠溶液中,反应离子方程式为AlO2- + CO2 + 2H2O == Al(OH)3↓ + HCO3-,故(3)正确;
(4)向碳酸氢铵溶液中加过量氢氧化钠溶液并加热,离子方程式:NH4+ + HCO3- + 2OH- ![]() CO32- + NH3↑ + 2H2O ,故(4)正确;
CO32- + NH3↑ + 2H2O ,故(4)正确;
(5) NaHCO3溶液与稀H2SO4反应的离子反应为HCO3-+H+═H2O+CO2↑,故(5)错误;
(6) MnO2与浓盐酸加热反应制Cl2,正确的离子方程式为:MnO2+2Cl-+4H+ ![]() Mn2++Cl2↑+2H2O,故(6)错误;
Mn2++Cl2↑+2H2O,故(6)错误;
(7) 水解为可逆反应,且生成胶体,不是沉淀,则明矾溶于水产生Al(OH)3胶体,离子方程式可表示为:Al3++3H2OAl(OH)3+3H+,故(7)错误;
(8) Ca(HCO3)2溶液与少量NaOH溶液反应的离子方程式为:HCO3- + Ca2+ +OH-==CaCO3↓+ H2O,故(8)正确;
(9) 向苯酚钠溶液中通入少量的CO2的离子反应为:C6H5O-+CO2+H2O→C6H5OH+HCO3-,故(9)错误;
(10) NO3-在酸性条件下具有强氧化性,将与I-发生氧化还原反应,故(10)错误;
综合以上分析,正确的有:⑶⑷⑻,故选C。