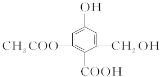
题目内容
【题目】某研究性学习小组设计了一组实验验证元素周期律.
Ⅰ.甲同学设计了如下图装置来一次性完成元素氮、碳、硅非金属性强弱的比较。
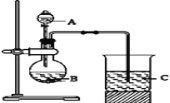
(1)甲同学在连接好仪器后,加入药品之前要检查装置气密性。首先关闭_____,将导管伸入烧杯液面以下,再_____,如果C中______,则说明________
(2)要证明氮、碳、硅非金属性强弱,在A中加________溶液,B中加____溶液,C中加________溶液,将观察到C中__________的现象.但老师认为,该现象不足以证明三者非金属性强弱,请用文字叙述理由_______。
(3)为避免上述问题,应在B、C之间增加一个盛有足量____(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置.改进后C中发生反应的离子方程式是__________ .
Ⅱ.丙同学设计了如下图装置来验证卤族元素性质的递变规律.A、B、C三处分别是沾有NaBr溶液的棉花、湿润淀粉KI试纸、湿润红纸.
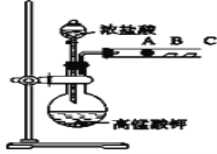
(1)请写出浓盐酸与高锰酸钾反应的离子方程式_________________
(2)A中棉花颜色变_______,则说明非金属性Cl>Br;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,最后得到的物质是_________
(3)丙同学利用此实验证明卤素单质氧化性:Cl2>Br2>I2,你认为合理吗____,(填“合理”或“不合理”)理由是___________ .
【答案】分液漏斗活塞 微热圆底烧瓶 有气泡产生,冷却至室温有一段液柱 气密性良好 HNO3 Na2CO3 Na2SiO3 白色浑浊 挥发出的硝酸可能和硅酸钠反应 D SiO32-+CO2+H2O═H2SiO3↓+CO32- 2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 橙黄色 NaCl和KCl 不合理 有多余的氯气,不能验证Br2和I2的氧化性强弱
【解析】
根据元素周期律中元素的非金属性递变规律及氧化还原反应的规律进行分析。第I部分根据元素的最高价含氧酸的酸性设计实验;第II部分是根据单质的氧化性设计实验。
Ⅰ.甲同学设计了一次性完成元素氮、碳、硅非金属性强弱的比较实验,则可以根据其最高价氧化物的水化物的酸性进行设计,即酸性HNO3>H2SiO3>H2CO3。
(1)在连接好仪器后,加入药品之前要检查装置气密性。首先关闭分液漏斗活塞,将导管伸入烧杯液面以下,再微热圆底烧瓶,如果C中有气泡产生,冷却至室温有一段液柱,则说明气密性良好。
(2)要证明氮、碳、硅非金属性强弱,在A中加HNO3溶液,B中加碳酸盐,可以是Na2CO3溶液,C中加可溶性的硅酸盐溶液,可以是Na2SiO3溶液,将观察到C中出现白色浑浊的现象,但该现象不足以证明三者非金属性强弱,因为硝酸具有挥发性,挥发出的硝酸可能和硅酸钠反应。
(3)为避免上述问题,应在B、C之间增加一个洗气装置,即盛有足量饱和NaHCO3溶液的洗气装置。
A.浓盐酸也有挥发性,也会干扰实验;
B.浓NaOH溶液会吸收CO2;
C.饱和Na2CO3溶液也会吸收CO2 ;
D.饱和NaHCO3溶液能吸收挥发出的硝酸,且能生成CO2,故只能选D。
改进后C中发生反应的离子方程式是SiO32-+CO2+H2O═H2SiO3↓+CO32- 。
Ⅱ.丙同学设计了验证卤族元素性质的递变规律根据图中信息,可以判断是通过比较其单质的氧化性而设计了实验。首先用浓盐酸与高锰酸钾反应制备Cl2,然后Cl2分别与A、B、C三处的沾有NaBr溶液的棉花、湿润淀粉KI试纸、湿润红纸反应。
(1)浓盐酸与高锰酸钾反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O 。
(2)A中发生置换反应生成Br2,棉花颜色变为橙黄色,则说明非金属性Cl>Br;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,发生置换反应生成Br2、I2、NaCl和KCl,将所得溶液蒸干并灼烧,Br2挥发为溴蒸气跑掉,I2升华碘蒸气跑掉,最后得到的物质是难挥发的NaCl和KCl。
(3)丙同学利用此实验证明卤素单质氧化性:Cl2>Br2>I2,这是不合理的,原因是有多余的氯气,不能证明Br2与KI发生了反应,因此不能验证Br2和I2的氧化性强弱。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
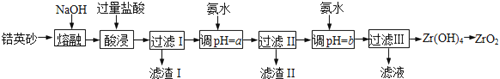
已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)熔融时ZrSiO4发生反应的化学方程式为 ,滤渣I的化学式为 。
(2)为使滤液I的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是 ;继续加氨水至pH=b时,所发生反应的离子方程式为 。
(3)向过滤III所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为 。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是 。