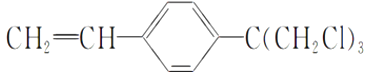
��Ŀ����
����Ŀ��������Ԫ�أ����ǵĽṹ�����ʵ���Ϣ���������
Ԫ�� | �ṹ�����ʵ���Ϣ |
A | �Ƕ������У���ϡ�������⣩ԭ�Ӱ뾶����Ԫ�� |
B | B��Aͬ���ڣ�������������ˮ��������� |
C | Ԫ�ص���̬�⻯�K������ˮ������������� |
D | �Ǻ�ˮ�г��⡢��Ԫ���⺬������Ԫ�أ��䵥�ʻ���Ҳ������ˮ���������г��õ�����ɱ���� |
E | ��̬ԭ�ӵ�M��ȫ������N��û�гɶԵ��ӣ�ֻ��һ��δ�ɶԵ��� |
����ݱ�����Ϣ��д��
��1��AԪ����Ԫ�����ڱ��е�λ�� ��
��2�����Ӱ뾶��BA������ڡ���С�ڡ�����
��3��Cԭ�ӵĵ����Ų�ͼ�� �� ��ԭ�Ӻ�������δ�ɶԵ��ӣ�������ߵĵ���Ϊ����ϵĵ��ӣ��������Σ�
��4��B������������Ӧ��ˮ������A������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ �� ��D����������ˮ����ˮ��Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��5��EԪ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ ��
���𰸡�
��1���������ڵڢ�A��
��2����
��3��![]() ��3��2p������
��3��2p������
��4��OH��+Al��OH��3�TAlO2��+2H2O��Al��OH��3+3HClO4�TAl��ClO4��3+3H2O��
��5��1s22s22p63s23p63d104s1��[Ar]3d104s1
���������⣺A�Ƕ������У���ϡ�������⣩ԭ�Ӱ뾶����Ԫ�أ���AΪNaԪ�أ�B��Aͬ���ڣ�������������ˮ��������ԣ���BΪAlԪ�أ�CԪ�ص���̬�⻯�K������ˮ�����������������CΪNԪ�أ�D�Ǻ�ˮ�г��⡢��Ԫ���⺬������Ԫ�أ��䵥�ʻ���Ҳ������ˮ���������г��õ�����ɱ��������DΪClԪ�أ�E�Ļ�̬ԭ�ӵ�M��ȫ������N��û�гɶԵ��ӣ�ֻ��һ��δ�ɶԵ��ӣ���E�ĵ����Ų�ʽӦΪ1s22s22p63s23p63d104s1 �� EΪCuԪ�أ���1��AΪNaԪ�أ�ԭ������Ϊ11��λ�����ڱ��е������ڵڢ�A�壬 ���Դ��ǣ��������ڵڢ�A�壻��2��BΪ��Ԫ�أ������Ӻ������ӵ��Ӳ�����ͬ���˵����Խ�����Ӱ뾶�뾶ԽС�����������Ӱ뾶С�������ӣ�
���Դ��ǣ�С�ڣ���3��CΪNԪ�أ���ԭ������Ϊ7��Nԭ�ӵĻ�̬ԭ�ӵĵ����Ų�ͼ�ǣ� ![]() ����ԭ�Ӻ�����3��δ�ɶԵ��ӣ�������ߵĵ���Ϊ2p����ϵĵ��ӣ����������壬
����ԭ�Ӻ�����3��δ�ɶԵ��ӣ�������ߵĵ���Ϊ2p����ϵĵ��ӣ����������壬
���Դ��ǣ� ![]() ��3��2p�����壻��4��BΪ��Ԫ�أ�DΪ��Ԫ�أ�B�����������Ϊ����������D������������ˮ����Ϊ�����ᣬ���߷�Ӧ�����ӷ���ʽΪ��OH��+Al��OH��3�TAlO2��+2H2O��D����������ˮ����ΪHClO4 �� HClO4������������Ӧ�Ļ�ѧ����ʽΪ��Al��OH��3+3HClO4�TAl��ClO4��3+3H2O��
��3��2p�����壻��4��BΪ��Ԫ�أ�DΪ��Ԫ�أ�B�����������Ϊ����������D������������ˮ����Ϊ�����ᣬ���߷�Ӧ�����ӷ���ʽΪ��OH��+Al��OH��3�TAlO2��+2H2O��D����������ˮ����ΪHClO4 �� HClO4������������Ӧ�Ļ�ѧ����ʽΪ��Al��OH��3+3HClO4�TAl��ClO4��3+3H2O��
���Դ��ǣ�OH��+Al��OH��3�TAlO2��+2H2O��Al��OH��3+3HClO4�TAl��ClO4��3+3H2O����5��EΪCuԪ�أ�ԭ������Ϊ29�����̬ԭ�ӵĵ����Ų�ʽΪ��1s22s22p63s23p63d104s1��[Ar]3d104s1 ��
���Դ��ǣ�1s22s22p63s23p63d104s1��[Ar]3d104s1 ��

 ��ѧ��ʦ����ϵ�д�
��ѧ��ʦ����ϵ�д�