题目内容
将2 mol H2O和2 mol CO置于1 L容器中,在一定条件下,加热至高温,发生如下可逆反应:2H2O(g)![]() 2H2+O2 2CO+O2
2H2+O2 2CO+O2![]() 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是____________和____________,或____________和____________。(填它们的化学式)
(2)若平衡时O2和CO2的物质的量分别为n平(O2)=a mol,n平(CO2)=b mol。试求n平(H2O)=____________mol(用含a,b的代数式表示)。
解析:(1)根据H原子、C原子守恒关系,无论混合气体的组成如何,H2O和H2的物质的量之和、CO和CO2的物质的量之和都为定值,所以当同时知道H2O和H2或CO和CO2浓度时,不能确定混合气体的组成。
(2)设平衡时H2O、CO转化的物质的量分别为x、y,由题意可知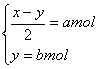 解得
解得![]()
所以n平(H2O)=2 mol-x=〔2-(2a+b)〕 mol
答案:(1)H2O H2 CO CO2
(2)2-2a-b

练习册系列答案
相关题目
