��Ŀ����
����Ŀ��������������־����־�����������й��ڰ�ͭ�ļ��أ���������ͭ��ͭ���Ͻ��������⣬����Ҫ������ң������������������Ʒ���ش��������⣺
��1����Ԫ�ػ�̬ԭ�ӵĵ����Ų�ʽΪ_________��3d�ܼ��ϵ�δ�ɶԵĵ�����Ϊ______��
��2�����������ڰ�ˮ�γ�[Ni(NH3)6]SO4��ɫ��Һ��
��[Ni(NH3)6]SO4�������ӵ����幹����_____��
����[Ni(NH3)6]2+��Ni2+��NH3֮���γɵĻ�ѧ����Ϊ______ ���ṩ�µ��ӶԵijɼ�ԭ����_____��
�����ķе�_____����������������������좣�PH3����ԭ����______������_____���ӣ����������������Ǽ�������������ԭ�ӵĹ���ӻ�����Ϊ_______��
��3������ͭ����������______���γɵľ��壺Ԫ��ͭ�����ĵڶ������ֱܷ�Ϊ��ICu=1958kJ/mol��INi=1753kJ/mol��ICu��INi��ԭ����______��
��4��ij����ͭ�Ͻ�����������ṹ��ͼ��ʾ��

��������ͭԭ������ԭ�ӵ�������Ϊ_____��
�����Ͻ���ܶ�Ϊdg/cm3����������a=________nm
���𰸡���1��1s22s22p63s23p63d84s2��[Ar] 3d84s2��2
��2������������
�������N
�����ڣ�NH3���Ӽ���γ���������ԣ�sp3
��3��������ͭʧȥ����ȫ������3d10���ӣ���ʧȥ����4s1����
��4����3:1
��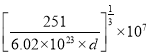
�������������������
��1��NiԪ��ԭ�Ӻ��������Ϊ28����������Ų�ʽΪ1s22s22p63s23p63d84s2��3d�ܼ��ϵ�δ�ɶԵ�����
Ϊ2��
�ʴ�Ϊ��1s22s22p63s23p63d84s2��[Ar] 3d84s2��2��
��2����SO42-��Sԭ�ӵŵ��Ӷ���=![]() =0���۲���Ӷ���=4+0=4�����ӿռ乹��Ϊ�������壬
=0���۲���Ӷ���=4+0=4�����ӿռ乹��Ϊ�������壬
�ʴ�Ϊ���������壻
��Ni2+�ṩ�չ����NH3��Nԭ�Ӻ��йµ��Ӷԣ�����֮���γ���λ����
�ʴ�Ϊ����λ����N��
��PH3����֮��Ϊ���»�������������֮���γ����������֮�����������ǿ�����������ʵķе㣬
�ʰ����ķе����PH3���ӵģ�NH3����Ϊ�����νṹ������������������IJ��غϣ����ڼ�
�Է��ӣ�Nԭ����1�Թ¶Ե��ӣ��γ�3��N-H�����ӻ������ĿΪ4����ԭ�Ӳ�ȡsp3�ӻ���
�ʴ�Ϊ�����ڣ���������֮���γ���������ԣ�sp3��
��3������ͭ���������ڽ������壬�����ɽ������γɵľ��壻Cu+����Χ�����Ų�Ϊ3d104s1��Ni+����
Χ�����Ų�Ϊ3d84s2��Cu+�ĺ�������Ų�3d�������ȫ�������ȶ�״̬����ʧȥ�ڶ������Ӹ��ѣ�
����ʧȥ����4s����ĵ��ӣ�����Ԫ��ͭ�ĵڶ������ܸ�������
�ʴ�Ϊ��������ͭʧȥ����ȫ������3d10���ӣ�Niʧȥ����4s1���ӣ�
��4����������Ni���ڶ��㣬Cu�������ģ�����Niԭ����ĿΪ8��![]() =1��Cuԭ����Ŀ=6��
=1��Cuԭ����Ŀ=6��![]() =3��
=3��
��Cu��Niԭ����Ŀ֮��Ϊ3��1��
�ʴ�Ϊ��3��1��
���������������ܶѻ���������������Ϊ![]() g������m=��V���У�
g������m=��V����![]() g="d" gcm-3
g="d" gcm-3
��(a��10-7cm)3�����a=![]() ��
��
�ʴ�Ϊ��![]() ��
��

����Ŀ���±���ʾʵ�飬����ͽ��۾���ȷ����
ѡ�� | ʵ�� | ���� | ���� |
A | ��Ũ�Ⱦ�Ϊ0.lmol/LNaCl��NaI�����Һ�еμ�����AgNO3��Һ | ���ֻ�ɫ���� | Ksp(AgCl)>Ksp(AgI) |
B | �����£��ⶨ�����ʵ���Ũ�ȵ� Na2CO3��Na2SO3��Һ��pHֵ | ǰ�ߵ�pHֵ�Ⱥ��ߵĴ� | �ǽ����ԣ�S>C |
C | ��ij��Һ�м��������ữ���Ȼ�����Һ | ��Һ���а�ɫ�������� | ����Һ�к���SO42- |
D | ��FeCl3��KSCN�����Һ�У���������KC1���� | ��Һ��ɫ��dz | FeCl3+3KSCN |
A. A B. B C. C D. D

