题目内容
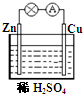 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )①Zn是负极 ②Cu是正极
③Zn-2e-═Zn2+ ④Cu2++2e-═Cu.
分析:锌、铜和稀硫酸组成的原电池中,锌为负极,发生氧化反应,电极方程式为Zn-2e-═Zn2+,铜为正极,正极发生还原反应,氢离子得到电子生成氢气,电解方程式为2H++2e-=H2↑,以此解答该题.
解答:解:锌比铜活泼,锌为负极,铜为正极,负极电极方程式为Zn-2e-═Zn2+,正极为2H++2e-=H2↑,则正确的为①②③,
故选B.
故选B.
点评:本题考查原电池知识,侧重于基础知识的考查,有利于培养学生的良好科学素养和提高学生学习的积极性,注意把握原电池的工作原理,难度不大.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( ) 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是( )
 对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法不正确的是( )
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法不正确的是( )