题目内容
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。
(1)基态亚铜离子(Cu+)的价层电子排布式为________;高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:______________________________________________。
(2)H2O的沸点高于H2Se的沸点(-42 ℃),其原因是___________________________。
(3)GaCl3和AsF3的立体构型分别是____________,____________。
(4)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4]-中B原子的杂化类型为______________。
②[B(OH)4]-的结构式为________________。
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是________________(用化学式表示);
②金刚石的晶胞参数为a pm(1 pm=10-12 m)。 1cm3晶体的平均质量为______________(只要求列算式,阿伏加德罗常数为NA)。
【答案】3d10 Cu2O中Cu+的价层电子排布处于稳定的全充满状态 水分子间存在氢键、H2Se分子间无氢键 平面三角形 三角锥型 sp3 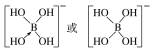 C>SiC>Si
C>SiC>Si ![]()
【解析】
(1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理书写Cu+基态核外电子排布式,轨道处于全空、半满或全满时最稳定;(2)H2O的分子间存在氢键;(3)根据价层电子对互斥理论来确定其空间构型;(4)在[B(OH)4]-中B原子与4个羟基相连,一对孤对电子对。
(1)Cu原子失去1个电子生成Cu+,Cu+核外有28个电子,失去的电子数是其最外层电子数,根据构造原理知Cu+基态核外电子排布式1s22s22p63s23p63d10或[Ar]3d10 ,则基态亚铜离子(Cu+)的价层电子排布式为3d10;原子轨道处于全空、半满或全满时最稳定,结构上Cu2+为3d9,而Cu+为3d10全充满更稳定,故高温下CuO容易转化为Cu2O;(2)H2O和H2Se都是极性分子,其分子间有色散力、诱导力、取向力。但由于H2O的分子间还有氢键存在,所以H2O沸点比H2Se沸点高;(3)GaCl3中价层电子对个数=3+![]() (3-3×1)=3,且没有孤电子对,所以其空间构型是平面三角形结构;AsF3中价电子对个数=3+
(3-3×1)=3,且没有孤电子对,所以其空间构型是平面三角形结构;AsF3中价电子对个数=3+![]() (5-3×1)=4,有一个孤电子对,所以其空间构型是三角锥形;(4)①在[B(OH)4]-中,硼原子最外层只有3个电子,与氧原子形成3对共用电子对,B原子与4个羟基相连,一对孤对电子对,为sp3杂化;②[B(OH)4]-离子中的配位键,氧元素提供孤对电子给硼元素O→B,可表示为
(5-3×1)=4,有一个孤电子对,所以其空间构型是三角锥形;(4)①在[B(OH)4]-中,硼原子最外层只有3个电子,与氧原子形成3对共用电子对,B原子与4个羟基相连,一对孤对电子对,为sp3杂化;②[B(OH)4]-离子中的配位键,氧元素提供孤对电子给硼元素O→B,可表示为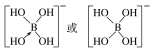 ;(5)①金刚石、晶体硅、碳化硅都是原子晶体,半径越小,熔点越高,故金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是C>SiC>Si;②根据分摊原则,立方氮化硼晶体的结构与金刚石相似,晶胞中共有8个原子,N和B各占4个。1cm3晶体的平均质量为
;(5)①金刚石、晶体硅、碳化硅都是原子晶体,半径越小,熔点越高,故金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是C>SiC>Si;②根据分摊原则,立方氮化硼晶体的结构与金刚石相似,晶胞中共有8个原子,N和B各占4个。1cm3晶体的平均质量为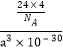 =
=![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在一定温度下、1L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示,下列有关说法正确的是
x | y | w | |
n(起始)/mol | 2 | l | 0 |
n(平衡)/mol | l | 0.5 | 1.5 |
A. 该温度下,此反应的平衡常数表达式是![]()
B. 升高温度,若w的体积分数减小,则此反应ΔH>0
C. 增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D. 该温度下,再向容器中通入3molw,达到平衡时,n(x)=2mol