题目内容
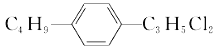
【题目】Geliening 是治疗白血病和多种癌症的一种抗癌药物,在其合成过程中的一种中间产物结构表 示如图,下列有关该中间产物的说法不正确的是( )
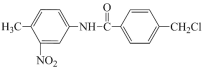
A.分子中含有3种官能团
B.该物质的分子式为C15H13O3N2Cl
C.该分子中最多有15 个碳原子共平面
D.1mol该物质可与1molNaOH发生反应
【答案】D
【解析】
A. 据有机物结构简式,分子中含有-NO2、-CONH-、-Cl三种官能团,故A正确;
B. 该物质的分子式为C15H13O3N2Cl,故B正确;
C. 两个苯环上的12个原子可以共面,与苯环相连的3个碳原子也可以和苯环共面,所以最多有15个碳原子共平面,故C正确;
D. 羧酸类的物质(-COOH)都能与氢氧化钠发生中和反应,酚类物质(酚羟基-OH)能与氢氧化钠反应,另外氨基酸或蛋白质能与碱反应(-CO-NH-肽键水解),油脂类物质的皂化反应是氢氧化钠使脂肪水解生成脂肪酸钠盐(-COO-酯键水解),卤代烃碱性溶液中发生水解反应,所以1mol该分子和氢氧化钠反应时消耗2molNaOH,故D错误;
故选D。

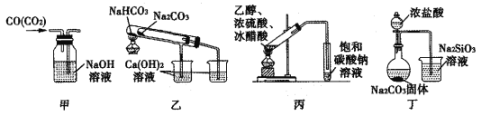
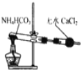
【题目】资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为_________;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
实验序号 | 实验 | 实验现象 | 结论 |
实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为___①______ |
实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量____②_____ | _____③____ | 白色不溶物可能含有猜测2中不溶物 |
实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 _____④____ |
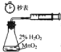
(3)为进一步确定实验1的产物,设计定量实验方案,如图所示:

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:_________;(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:_________。
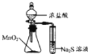
【题目】下列实验能达到目的是
实验目的 | 实验步骤 | |
A | 检验溶液中是否存在 | 用洁净的玻璃棒蘸取少量溶液在酒精灯上灼烧,观察火焰颜色 |
B | 检验久置的 | 取样配成溶液,加入盐酸酸化,再加 |
C | 检验碳单质与浓硫酸反应的产物 | 将反应生成的气体依次通过无水硫酸铜粉末、澄清石灰水、品红溶液 |
D | 检验碘盐中是否含有碘元素 | 取样配成溶液,加入淀粉溶液,观察溶液是否变蓝 |
A.AB.BC.CD.D