题目内容
科学家提出酸度新概念--AG,用AG表示溶液酸碱性强弱,能克服pH表示溶液酸碱度的缺点,AG=lg
.25℃时,现有物质的量浓度为0.4mol?L-1的HA溶液与0.2mol?L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和).
(1)若HA为HCl,则混合溶液的AG= .
(2)若HA为HCN,且溶液中c(Na+)>c(CN-),则溶液显 (填“酸性”“碱性”或“中性”),混合溶液中离子浓度大小顺序为: .
(3)若HA为CH3COOH,且混合溶液的AG>0,溶液中粒子浓度正确的是 .
A.c(Na+)=c(CH3COOH)+c(CH3COO-) B.c(CH3COO-)>c(Na+)
C.c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH) D.c(H+)+c(CH3COOH)=c(Na+)+c(OH-)
| c(H+) | c(OH-) |
(1)若HA为HCl,则混合溶液的AG=
(2)若HA为HCN,且溶液中c(Na+)>c(CN-),则溶液显
(3)若HA为CH3COOH,且混合溶液的AG>0,溶液中粒子浓度正确的是
A.c(Na+)=c(CH3COOH)+c(CH3COO-) B.c(CH3COO-)>c(Na+)
C.c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH) D.c(H+)+c(CH3COOH)=c(Na+)+c(OH-)
分析:(1)25℃时,现有物质的量浓度为0.4mol?L-1的HA溶液与0.2mol?L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和),若HA为HCl,得到的溶液为NaCl和HCl混合溶液,依据化学方程式计算剩余溶液中HCl的浓度,得到氢离子浓度,结合AG概念计算得到;
(2)25℃时,现有物质的量浓度为0.4mol?L-1的HA溶液与0.2mol?L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和),若HA为HCN,得到混合溶液为NaCN和HCN,且溶液中c(Na+)>c(CN-),依据溶液中电荷守恒分析判断溶液酸碱性,结合溶质判断离子浓度大小;
(3)25℃时,现有物质的量浓度为0.4mol?L-1的HA溶液与0.2mol?L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和),若HA为CH3COOH,得到混合溶液溶质为CH3COOH和CH3COONa,混合溶液的AG>0,说明
>1,溶液中醋酸电离程度大于醋酸根离子水解程度,结合溶液中物料守恒和电荷守恒分析选项;
(2)25℃时,现有物质的量浓度为0.4mol?L-1的HA溶液与0.2mol?L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和),若HA为HCN,得到混合溶液为NaCN和HCN,且溶液中c(Na+)>c(CN-),依据溶液中电荷守恒分析判断溶液酸碱性,结合溶质判断离子浓度大小;
(3)25℃时,现有物质的量浓度为0.4mol?L-1的HA溶液与0.2mol?L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和),若HA为CH3COOH,得到混合溶液溶质为CH3COOH和CH3COONa,混合溶液的AG>0,说明
| c(H+) |
| c(OH-) |
解答:解:(1)25℃时,现有物质的量浓度为0.4mol?L-1的HA溶液与0.2mol?L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和),若HA为HCl,得到的溶液为NaCl和HCl混合溶液,依据化学方程式计算剩余溶液中HCl的浓度=0.1mol/L,得到氢离子浓度为0.1mol/L,溶液中离子积常数计算c(OH-)=
=10-13(mol/L),溶液AG=lg
=12;
故答案为:12;
(2)若HA为HCN,得到混合溶液为NaCN和HCN,且溶液中c(Na+)>c(CN-),依据溶液中电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CN-),得到c(OH-)>c(H+),则溶液显碱性,水解大于电离,溶液中离子浓度大小为:c(Na+)>c(CN-)>c(OH-)>c(H+);
故答案为:碱性,c(Na+)>c(CN-)>c(OH-)>c(H+);
(3)25℃时,现有物质的量浓度为0.4mol?L-1的HA溶液与0.2mol?L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和),若HA为CH3COOH,得到混合溶液溶质为CH3COOH和CH3COONa,混合溶液的AG>0,说明
>1,溶液中醋酸电离程度大于醋酸根离子水解程度;
A.依据溶液中物料守恒得到,2c(Na+)=c(CH3COOH)+c(CH3COO-),故A错误;
B.溶液中的电荷守恒,c(H+)+c(Na+)=c(OH-)+c(CH3COO-),溶液呈酸性,c(OH-)<c(H+),c(CH3COO-)>c(Na+),故B正确;
C.溶液中电荷守恒分析可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故C错误;
D.依据物料守恒和电荷守恒分析可知,①电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),②物料守恒为2c(Na+)=c(CH3COOH)+c(CH3COO-),②-①得到c(H+)+c(CH3COOH)=c(Na+)+c(OH-),故D正确;
故答案为:BD;
| 10-14 |
| 0.1 |
| 0.1 |
| 10-13 |
故答案为:12;
(2)若HA为HCN,得到混合溶液为NaCN和HCN,且溶液中c(Na+)>c(CN-),依据溶液中电荷守恒,c(Na+)+c(H+)=c(OH-)+c(CN-),得到c(OH-)>c(H+),则溶液显碱性,水解大于电离,溶液中离子浓度大小为:c(Na+)>c(CN-)>c(OH-)>c(H+);
故答案为:碱性,c(Na+)>c(CN-)>c(OH-)>c(H+);
(3)25℃时,现有物质的量浓度为0.4mol?L-1的HA溶液与0.2mol?L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和),若HA为CH3COOH,得到混合溶液溶质为CH3COOH和CH3COONa,混合溶液的AG>0,说明
| c(H+) |
| c(OH-) |
A.依据溶液中物料守恒得到,2c(Na+)=c(CH3COOH)+c(CH3COO-),故A错误;
B.溶液中的电荷守恒,c(H+)+c(Na+)=c(OH-)+c(CH3COO-),溶液呈酸性,c(OH-)<c(H+),c(CH3COO-)>c(Na+),故B正确;
C.溶液中电荷守恒分析可知,c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故C错误;
D.依据物料守恒和电荷守恒分析可知,①电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),②物料守恒为2c(Na+)=c(CH3COOH)+c(CH3COO-),②-①得到c(H+)+c(CH3COOH)=c(Na+)+c(OH-),故D正确;
故答案为:BD;
点评:本题考查了溶液中离子积常数计算,溶液AG概念的分析判断,电解质溶液中电荷守恒、物料守恒和离子浓度浓度大小比较的应用,题目难度中等.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
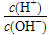 。25 ℃时,现有物质的量浓度为0.4 mol·L-1的HA溶液与0.2 mol·L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和)。
。25 ℃时,现有物质的量浓度为0.4 mol·L-1的HA溶液与0.2 mol·L-1的NaOH溶液等体积混合(溶液总体积近似等于两种溶液体积之和)。