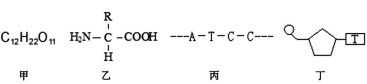题目内容
【题目】(1)下列物质: ①Cu ②SO2③冰醋酸④NaHCO3⑤Cu(OH )2⑥ H2SO4溶液⑦NaCl,属于非电解质的是____________(填序号),属于强电解质的是_______(填序号)。
(2)写出NaHCO3水解的离子方程式:______________________。
(3)已知Ksp[Cu(OH)2]=2×10-20,常温下某CuSO4溶液里,c(Cu2+)=2.0 mol/L,如要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于_______。
(4)现有25℃、pH=1的H2SO4溶液,该溶液的物质的量浓度为______,溶液中由水电离出的c(OH-)=_____。
(5)电解饱和食盐水溶液时,电极上生成了气体A 和B,气体B是____(填化学式);从阴极析出1.42L气体A,从阳极析出________L气体B(在标准状况下)。

【答案】 ② ④⑦ HCO3-+H2O![]() H2CO3+OH- 4 0.05 mol·L-1 1×10-13 mol·L-1 Cl2 1.42
H2CO3+OH- 4 0.05 mol·L-1 1×10-13 mol·L-1 Cl2 1.42
【解析】(1)本题考查强弱电解质、电解质和非电解质,非电解质:在水溶液或熔融状态都不能导电的化合物,属于非电解质的是②,强电解质包括强酸、强碱、多数的盐,因此属于强电解质的是④⑦;(2)考查水解方程式的书写,HCO3-属于弱酸根,发生水解,其水解方程式为HCO3-+H2O ![]() H2CO3+OH-;(3)本题考查溶度积的计算,根据Ksp=c(Cu2+)×c2(OH-),求出此时c(OH-)=1×10-10mol/L,即c(H+)=Kw/c(OH-)=10-4mol·L-1,即当pH=4时,此时的溶液为饱和氢氧化铜溶液,即当pH>4时,出现沉淀;(4)本题考查水的离子积的计算,pH=1推出溶液中c(H+)=0.1mol·L-1,即c(H2SO4)=0.1/2mol·L-1=0.05mol·L-1,水的离子积适合于稀溶液,即硫酸中水电离的c(OH-)=Kw/c(H+)=10-14/10-1mol·L-1=10-13mol·L-1;(5)考查电解原理,以及电解的计算,根据电解原理,阳极上Cl-先放电,阳极反应式为2Cl--2e-=Cl2↑,气体B为Cl2,阴极反应式为2H++2e-=H2↑,因此建立关系式为H2~2e-~Cl2,V(H2)=v(Cl2)=1.42L。
H2CO3+OH-;(3)本题考查溶度积的计算,根据Ksp=c(Cu2+)×c2(OH-),求出此时c(OH-)=1×10-10mol/L,即c(H+)=Kw/c(OH-)=10-4mol·L-1,即当pH=4时,此时的溶液为饱和氢氧化铜溶液,即当pH>4时,出现沉淀;(4)本题考查水的离子积的计算,pH=1推出溶液中c(H+)=0.1mol·L-1,即c(H2SO4)=0.1/2mol·L-1=0.05mol·L-1,水的离子积适合于稀溶液,即硫酸中水电离的c(OH-)=Kw/c(H+)=10-14/10-1mol·L-1=10-13mol·L-1;(5)考查电解原理,以及电解的计算,根据电解原理,阳极上Cl-先放电,阳极反应式为2Cl--2e-=Cl2↑,气体B为Cl2,阴极反应式为2H++2e-=H2↑,因此建立关系式为H2~2e-~Cl2,V(H2)=v(Cl2)=1.42L。