题目内容
下列关于化学反应速率的说法正确的是( )
| A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加 |
| B.化学反应速率为“0.8mol/(L·s)”所表示的意思是:时间为1s时,某物质的浓度为0.8mol·L-1 |
| C.根据化学反应速率的大小可以知道化学反应进行得快慢 |
| D.对于任何化学反应来说,反应速率越大,反应现象就越明显 |
C
解析

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
Fenton试剂常用于氧化降解有机污染物X。在一定条件下.反应初始时c(X)=2.0×10-3 mol·L-1,反应10 min进行测定,得图1和图2。下列说法不正确的是
| A.50oC,PH在3~6之间,X降解率随PH增大而减小 |
| B.PH=2,温度在40~80 oC,X降解率温度升高而增大 |
| C.无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80 oC |
| D.PH=2、温度为50oC,10min内v(X)=1.44x10-4 mol·L-1min-1 |
在恒温、恒容的密闭容器中发生反应A(g) B(g)+C(g),若反应物的浓度由2 mol/L降到0.8 mol/L需20 s,那么反应物浓度由0.8 mol/L降到0.2 mol/L所需的时间为
B(g)+C(g),若反应物的浓度由2 mol/L降到0.8 mol/L需20 s,那么反应物浓度由0.8 mol/L降到0.2 mol/L所需的时间为
| A.10 s | B.大于10 s | C.小于10 s | D.无法判断 |
煤本身是可燃物质,但是块状的煤用明火靠近都不燃烧,而当煤变为粉末状态时,在空气中达到一定的浓度遇明火即迅速爆炸,其原因是( )。
| A.粉末状态的煤比块状煤的着火点低 |
| B.粉末状态的煤比块状煤放出的热量多 |
| C.粉末状态的煤比块状煤的总表面积大 |
| D.粉末状态的煤呈气态,属于可燃性气体 |
对于可逆反应H2(g)+I2(g) 2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是( )
| A.H2(g)的消耗速率与HI(g)的生成速率之比为2∶1 |
| B.反应进行的净速率是正、逆反应速率之差 |
| C.正、逆反应速率的比值是恒定的 |
| D.达到平衡时,正、逆反应速率相等 |
一定条件下,可逆反应2A(g) B(g)+3C(g),下列四项中处于平衡状态的是( )
B(g)+3C(g),下列四项中处于平衡状态的是( )
| | 正反应速率 | 逆反应速率 |
| A | v(A)=2mol/(L·min) | v(B)=2mol/(L·min) |
| B | v(A)=2mol/(L·min) | v(C)=2mol/(L·min) |
| C | v(A)=1mol/(L·min) | v(B)=2mol/(L·min) |
| D | v(A)=1mol/(L·min) | v(C)=1.5mol/(L·min) |
其他条件不变时,能使反应速率加快的是( )
| A.对于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,增大体系的压强 |
B.对于N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入Ar 2NH3(g),容器体积固定不变时,充入Ar |
C.对于N2(g)+3H2(g) 2NH3(g),容器体积固定不变时,充入N2 2NH3(g),容器体积固定不变时,充入N2 |
D.对于N2(g)+3H2(g) 2NH3(g),容器气体压强不变时,充入Ar 2NH3(g),容器气体压强不变时,充入Ar |
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)??2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )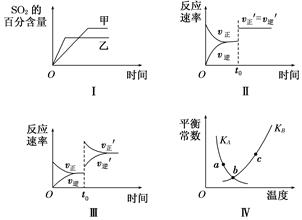
| A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
| D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态 |
 2C(g)达到平衡状态标志的是( )。
2C(g)达到平衡状态标志的是( )。