题目内容
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:

回答下列问题:.
(1)固体1含有的物质是_________、CaCO3、Ca(OH)2;捕获剂所捕获的气体主要是_______________。
(2)若X是空气,则上述反应中NO和O2的物质的量之比最好为___________,若空气过量,导致的结果会是____________________________。
(3)流程中处理含NH4+废水时发生反应的离子方程式为____________________________。气体1也可通过催化剂直接转化成无污染气体,反应的化学方程式为_____________________________________。
(4)若工业废气中主要含N2、SO2,不考虑其他成分,则可用下列工艺生产NaHSO3过饱和溶液[NaHSO3过饱和溶液是生产焦亚硫酸钠(Na2S2O5)的原料]。
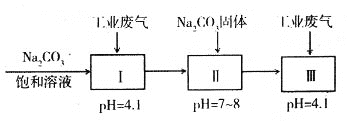
pH=4.1时,I中反应的化学方程式为_________________________;工艺中加入Na2CO3
固体、并再次通入废气的目的是_______________________________。
【答案】CaSO3 CO 4:1 NO将会被氧化成NaNO3,无法与NH4+反应生成无污染的N2 NH4++NO2-=N2↑+2H2O 2NO+2CO![]() N2+ 2CO2 Na2CO3+2SO2+H2O=2NaHSO3+CO2 加入Na2CO3固体会生成NaHCO3,再次通入废气,又重新生成NaHSO3,得到亚硫酸氢钠的过饱和溶液
N2+ 2CO2 Na2CO3+2SO2+H2O=2NaHSO3+CO2 加入Na2CO3固体会生成NaHCO3,再次通入废气,又重新生成NaHSO3,得到亚硫酸氢钠的过饱和溶液
【解析】
(1)石灰乳的成分为Ca(OH)2,能与CO2、SO2反应生成CaCO3、CaSO3,加入石灰乳过量,还有剩余的Ca(OH)2;NO被X气体氧化生成的NO2 被NaOH溶液吸收,所以气体2中被捕获剂捕获的气体主要为CO;综上所述,本题答案是:CaSO3,CO。
(2)根据反应流程可知,当反应物恰好完全反应生成了亚硝酸钠,二者配比为最佳配比;设NO为xmol、O2 ymol,根据电子得失守恒可知,x×(3-2)= y×2×2,所以x:y=4:1;若空气过量,NO将会被氧化而生成NaNO3,无法与废水中的NH4+反应生成无污染的N2;综上所述,本题答案是:4:1;NO将会被氧化而生成NaNO3,无法与NH4+反应生成无污染的N2。
(3) NH4+与亚硝酸根离子反应生成氮气,反应的离子方程式为:NH4++NO2-=N2↑+2H2O;气体1中含有NO、CO,通过催化剂直接转化成无污染气体氮气和二氧化碳,化学方程式为:2NO+2CO![]() N2+ 2CO2;综上所述,本题答案是:NH4++NO2-=N2↑+2H2O;2NO+2CO
N2+ 2CO2;综上所述,本题答案是:NH4++NO2-=N2↑+2H2O;2NO+2CO![]() N2+ 2CO2。
N2+ 2CO2。
(4)pH=4.1时,I中碳酸钠与二氧化硫反应生成亚硫酸氢钠和二氧化碳,反应的化学方程式为:Na2CO3+2SO2+H2O=2NaHSO3+CO2;工艺中加入Na2CO3固体会生成NaHCO3,再次通入废气,又重新生成NaHSO3,得到亚硫酸氢钠的过饱和溶液;综上所述,本题答案是:Na2CO3+2SO2+H2O=2NaHSO3+CO2;加入Na2CO3固体会生成NaHCO3,再次通入废气,又重新生成NaHSO3,得到亚硫酸氢钠的过饱和溶液。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案