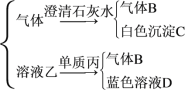题目内容
【题目】现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制480 mL 0.5 mol·L-1的稀硫酸。可供选择的仪器如下图

请回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是___________(填序号),配制上述溶液还需用到的玻璃仪器是_______________(填仪器名称)。
(2)使用容量瓶之前必须进行的操作是______________________________。
(3)经计算,需浓硫酸的体积为_____mL(小数点后保留 1位小数)。现有 ①10 mL
②50 mL ③100 mL三种规格的量筒,你选用的量筒是____(填序号)。
(4)配制溶液时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 其正确的操作顺序为:②→①→③→_________(填序号)。
(5)在配制过程中,其他操作都准确,下列操作使所配溶液浓度偏高的是_______ (填序号)
①洗涤量取浓硫酸的量筒,并将洗涤液转移到容量瓶中
②稀释后的硫酸溶液未等冷却至室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
⑤定容时俯视刻度线
【答案】BE 胶头滴管、玻璃棒 检查容量瓶是否漏水 13.6 ② ⑤⑥⑦④ ①②⑤
【解析】
(1)根据配制一定物质的量浓度溶液的步骤判断仪器;
(2)使用容量瓶之前必须检查容量瓶是否漏水;
(3)依据![]() ,计算质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度,再依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸的体积,依据浓硫酸体积选择合适规格的量筒;
,计算质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度,再依据溶液稀释过程中所含溶质的物质的量不变计算需要浓硫酸的体积,依据浓硫酸体积选择合适规格的量筒;
(4)依据配制一定物质的量浓度溶液的一般步骤排序;
(5)依据配制一定物质的量浓度溶液的正确操作步骤判断,根据![]() 分析操作对溶质的物质的量或对溶液的体积的影响判断。
分析操作对溶质的物质的量或对溶液的体积的影响判断。
(1)用浓硫酸配制一定物质的量浓度的稀硫酸的步骤有:计算、量取、稀释、转移、洗涤、定容、摇匀等,使用的仪器有:量筒、烧杯、玻璃棒、容量瓶、胶头滴管,不需要的仪器有托盘天平和分液漏斗,还缺少的仪器:玻璃棒、胶头滴管;
故答案为:BE;胶头滴管、玻璃棒;
(2)使用容量瓶之前必须进行的操作是检查容量瓶是否漏水;
故答案为:检查容量瓶是否漏水;
(3)质量分数为98%、密度为1.84g/cm3的浓硫酸物质的量浓度为:![]() ,配制450mL溶液,应选择500mL容量瓶,实际配制500mL溶液,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变可得:V×18.4mol/L=0.5mol/L×0.5L,解得:V=0.0136L=13.6mL,应选择25mL量筒;
,配制450mL溶液,应选择500mL容量瓶,实际配制500mL溶液,设需要浓硫酸体积为V,则依据溶液稀释过程中所含溶质的物质的量不变可得:V×18.4mol/L=0.5mol/L×0.5L,解得:V=0.0136L=13.6mL,应选择25mL量筒;
故答案为:13.6;②;
(4)配制一定物质的量浓度溶液的一般步骤:计算、称量(量取)、溶解(稀释)、冷却、转移、洗涤、定容、摇匀等,所以正确的操作为:②→①→③→⑤→⑥→⑦→④;
故答案为:⑤⑥⑦④;
(5)①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中,导致量取的浓硫酸体积偏大,硫酸的物质的量偏大,溶液浓度偏高;
②稀释后的硫酸溶液未等冷却至室温就转移到容量瓶中,浓硫酸稀释产生大量的热,冷却后溶液体积偏小,溶液浓度偏高;
③转移前,容量瓶中含有少量蒸馏水,对溶液浓度无影响;
④定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏低;
⑤定容时俯视刻度线,导致溶液体积偏小,配制溶液的浓度偏高;
综上所述,以上操作会使所配溶液浓度偏高的是①②⑤;
故答案为:①②⑤。

【题目】民间艺术是劳动人民智慧的结晶,下列中国传统民间艺术在表演过程中涉及化学变化的是
A | B | C | D |
刺绣 | 打树花 | 剪纸 | 织锦 |
|
|
|
|
用针线在织物上 绣制图案 | 将熔化的铁水泼向 空中,迸溅出火花 | 用剪刀或刻刀在纸上剪刻花纹 | 用提花机织出图案 |
A. AB. BC. CD. D
【题目】Ⅰ、在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(选填吸热、放热)。
(2)能判断该反应是否达到化学平衡状态的依据是_________。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 _________℃。
Ⅱ、向一体积不变的密闭容器中充入2 mol A、0.6 mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g) ![]() 3C(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
3C(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出。图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。

(1)若t1=15 min,则t0~t1阶段以C的浓度变化表示的反应速率V(C)=_____。
(2)t3时改变的条件为___________,B的起始物质的量为_______。
(3)t4~t5阶段,若A的物质的量减少了0.01 mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式___________________。