题目内容
现有钠、镁、铝质量分别为2.3g、2.4g、2.7g,使其分别于足量的盐酸溶液充分反应后,所得H2的质量关系正确的是
- A.氢气质量相同
- B.钠放出氢气最多,镁铝相同
- C.钠放出氢气最多,铝最少
- D.铝放出氢气最多,钠最少
D
分析:根据n= 计算各金属的物质的量,盐酸足量,金属完全反应,根据电子转移守恒计算生成的氢气的物质的量,据此判断.
计算各金属的物质的量,盐酸足量,金属完全反应,根据电子转移守恒计算生成的氢气的物质的量,据此判断.
解答:2.3gNa的物质的量为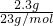 =0.1mol,反应中Na表现+1价,金属完全反应,故生成氢气的物质的量为
=0.1mol,反应中Na表现+1价,金属完全反应,故生成氢气的物质的量为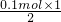 =0.05mol,
=0.05mol,
2.4gMg的物质的量为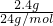 =0.1mol,反应中Mg表现+2价,金属完全反应,故生成氢气的物质的量为
=0.1mol,反应中Mg表现+2价,金属完全反应,故生成氢气的物质的量为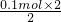 =0.1mol,
=0.1mol,
2.7g的物质的量为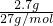 =0.1mol,反应中Al表现+3价,金属完全反应,故生成氢气的物质的量为
=0.1mol,反应中Al表现+3价,金属完全反应,故生成氢气的物质的量为 =0.15mol,
=0.15mol,
氢气的物质的量越大,其质量越大,故选D.
点评:本题考查金属与酸的反应的计算,题目难度中等,注意盐酸过量金属完全反应.
分析:根据n=
 计算各金属的物质的量,盐酸足量,金属完全反应,根据电子转移守恒计算生成的氢气的物质的量,据此判断.
计算各金属的物质的量,盐酸足量,金属完全反应,根据电子转移守恒计算生成的氢气的物质的量,据此判断.解答:2.3gNa的物质的量为
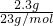 =0.1mol,反应中Na表现+1价,金属完全反应,故生成氢气的物质的量为
=0.1mol,反应中Na表现+1价,金属完全反应,故生成氢气的物质的量为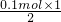 =0.05mol,
=0.05mol,2.4gMg的物质的量为
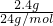 =0.1mol,反应中Mg表现+2价,金属完全反应,故生成氢气的物质的量为
=0.1mol,反应中Mg表现+2价,金属完全反应,故生成氢气的物质的量为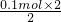 =0.1mol,
=0.1mol,2.7g的物质的量为
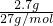 =0.1mol,反应中Al表现+3价,金属完全反应,故生成氢气的物质的量为
=0.1mol,反应中Al表现+3价,金属完全反应,故生成氢气的物质的量为 =0.15mol,
=0.15mol,氢气的物质的量越大,其质量越大,故选D.
点评:本题考查金属与酸的反应的计算,题目难度中等,注意盐酸过量金属完全反应.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
现有钠、镁、铝质量分别为2.3g、2.4g、2.7g,使其分别于足量的盐酸溶液充分反应后,所得H2的质量关系正确的是( )
| A、氢气质量相同 | B、钠放出氢气最多,镁铝相同 | C、钠放出氢气最多,铝最少 | D、铝放出氢气最多,钠最少 |