题目内容
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是
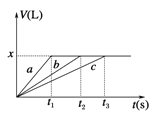
A. x=2.24
B. 铝的物质的量为0.2 mol
C. 反应时,Na、Mg、Al均过量
D. 曲线b为Mg与盐酸反应的图像
【答案】C
【解析】试题分析:由于最后生成的气体量相同,所以这些金属置换出的氢气量相等,即等物质的量的三种金属失去了相同数量的电子,而若盐酸过量的话,这些金属失去的电子数因该是不一样的,比值应是1:2:3,所以推断出盐酸不可能过量,但可能刚好和Na反应完全,此时Na完全反应而Mg、Al还有剩余,A.由于酸不足,所以生成氢气的量为:n(H2)=1/2n(HCl)=0.1×2÷2=0.1mol,所以标况下的体积为2.24L,A项正确;B.生成0.1mol的氢气需0.2mol的钠,B项正确;C.Na不可能过量,若Na过量会与溶剂水反应,C项错误;D.按照金属活动性顺序,Na>Mg>Al,则中间那条线是Mg与盐酸反应的图象,D项正确;答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


