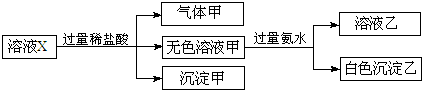
题目内容
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、Si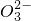 、S
、S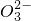 、C
、C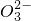 、S
、S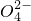 中的若干种离子(水电离出的H+、OH-忽略不计).某同学对该溶液进行了如下实验:下列判断正确的是
中的若干种离子(水电离出的H+、OH-忽略不计).某同学对该溶液进行了如下实验:下列判断正确的是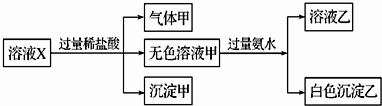
- A.沉淀甲是硅酸和硅酸镁的混合物
- B.K+、AlO2-和Si
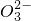 一定存在于溶液X中
一定存在于溶液X中 - C.气体甲一定是纯净物
- D.C
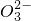 和S
和S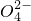 一定不存在于溶液X中
一定不存在于溶液X中
B
分析:能和盐酸反应获得气体的是碳酸根或是亚硫酸根离子,会生成沉淀的是硅酸根离子,碳酸根离子和镁离子以及铝离子不能共存于溶液中,能和过量的氨水反应生成的白色沉淀只能是氢氧化铝,偏铝酸根离子和过量的盐酸反应会生成铝离子,根据离子之间的反应以及实验现象确定存在的离子.
解答:加HCl有气体说明有CO32-、SO32-中的至少一种离子,生成的气体可以是二氧化碳、或是二氧化硫或是二者的混合物,一定不存在和碳酸根或是亚硫酸根不共存的离子,所以不存在镁离子、铝离子,加盐酸有沉淀,说明一定有硅酸根离子,硅酸是沉淀,加入过量氨水(提供OH-)有沉淀生成,只能是氢氧化铝沉淀,说明此时溶液中存在铝离子,但是原来溶液中的铝离子一定不能存在,所以该铝离子是偏铝酸根离子和盐酸反应生成的,所以,一定存在偏铝酸根离子,要保证溶液电中性,只有K+这一个阳离子,所以一定存在钾离子.
A、溶液中一定含有CO32-、SO32-中的至少一种离子,则一定不含有镁离子,它们和镁离子不共存,所以沉淀甲是硅酸,不可能是硅酸镁,故A错误;
B、根据上述推断,溶液中一定含有K+、AlO2-和SiO32-,故B正确;
C、加HCl有气体说明有CO32-、CO32-中的至少一种离子,生成的气体可以是二氧化碳、或是二氧化硫或是二者的混合物,故C错误;
D、碳酸根和硫酸根离子是否存在不能确定,故D错误.
故选B.
点评:本题涉及离子的检验和离子共存等方面的知识,注意离子的特征离子反应是解决该问题的关键所在,综合性强,难度大.
分析:能和盐酸反应获得气体的是碳酸根或是亚硫酸根离子,会生成沉淀的是硅酸根离子,碳酸根离子和镁离子以及铝离子不能共存于溶液中,能和过量的氨水反应生成的白色沉淀只能是氢氧化铝,偏铝酸根离子和过量的盐酸反应会生成铝离子,根据离子之间的反应以及实验现象确定存在的离子.
解答:加HCl有气体说明有CO32-、SO32-中的至少一种离子,生成的气体可以是二氧化碳、或是二氧化硫或是二者的混合物,一定不存在和碳酸根或是亚硫酸根不共存的离子,所以不存在镁离子、铝离子,加盐酸有沉淀,说明一定有硅酸根离子,硅酸是沉淀,加入过量氨水(提供OH-)有沉淀生成,只能是氢氧化铝沉淀,说明此时溶液中存在铝离子,但是原来溶液中的铝离子一定不能存在,所以该铝离子是偏铝酸根离子和盐酸反应生成的,所以,一定存在偏铝酸根离子,要保证溶液电中性,只有K+这一个阳离子,所以一定存在钾离子.
A、溶液中一定含有CO32-、SO32-中的至少一种离子,则一定不含有镁离子,它们和镁离子不共存,所以沉淀甲是硅酸,不可能是硅酸镁,故A错误;
B、根据上述推断,溶液中一定含有K+、AlO2-和SiO32-,故B正确;
C、加HCl有气体说明有CO32-、CO32-中的至少一种离子,生成的气体可以是二氧化碳、或是二氧化硫或是二者的混合物,故C错误;
D、碳酸根和硫酸根离子是否存在不能确定,故D错误.
故选B.
点评:本题涉及离子的检验和离子共存等方面的知识,注意离子的特征离子反应是解决该问题的关键所在,综合性强,难度大.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目