题目内容
【题目】弱电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
醋酸在水溶液中的电离方程式为 ______________________。
(2)用 0.1 mol·L-1NaOH 溶液分别滴定体积均为 20.00 mL、浓度均为 0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
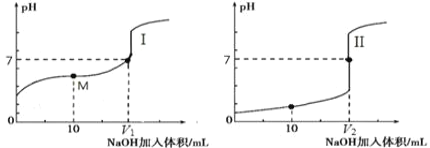
①滴定醋酸的曲线是_______________(填“I”或“II”)。
②室温时,若 0.1 mol·L-1的醋酸的电离度为 1%,计算这醋酸溶液的 pH 值________。
③滴定开始前,三种溶液中由水电离出的 c(H+)最大的是________________________。
④上述用 0.1 mol·L-1的 NaOH 溶液滴定 0.1 mol·L-1的盐酸,下列操作不正确的是____________________________。
A.用标准 NaOH 溶液润洗碱式滴定管后,再装入标准碱溶液
B.用待测酸溶液润洗锥形瓶后,再装入待测酸溶液
C.滴定时两眼应注视滴定管中液面的变化,以免滴定过量
D.读数时,视线应与滴定管凹液面的最低点保持水平
⑤上述滴定绝不能用___________作指示剂,若使用酚酞作指示剂则滴定终点的现象是_______________。
【答案】(1)①CH3COOHCH3COO-+H+ I 3 0.1molL-1醋酸溶液 BC 石蕊 加入最后一滴氢氧化钠,锥形瓶内溶液的颜色由无色变为粉红色,半分钟内不恢复
【解析】
(1)醋酸为弱酸,在水溶液中部分电离;
(2)①0.1mol·L-1的醋酸溶液的pH>1,0.1mol·L-1的盐酸的pH=1,观察滴定曲线的起点进行判断;
②0.1mol·L-1的醋酸的电离度为1%,由CH3COOHCH3COO-+H+可知溶液中c(H+)=0.1mol·L-1×1%=0.001mol·L-1,进而计算pH;
③酸或碱电离出的c(H+)或c(OH-)越小,其对水的电离的抑制作用较小,则由水电离出的c(H+)最大;
④A. 用标准NaOH溶液润洗碱式滴定管后,再装入标准碱溶液;
B.不能用待测酸溶液润洗锥形瓶,用蒸馏水洗净锥形瓶后,直接装入待测酸溶液;
C. 滴定时两眼应注视锥形瓶内溶液颜色的变化;
D. 读数时,视线应与滴定管凹液面的最低点保持水平;
⑤由于石蕊的变色范围比较宽,且现象不明显,因此上述滴定绝不能用石蕊作指示剂,可选择酚酞或者甲基橙作指示剂,其中酚酞遇酸无色,遇碱变为红色,若使用酚酞作指示剂,则滴定终点的现象是:滴入最后一滴氢氧化钠溶液时,溶液颜色恰好由无色变为粉红色,且半分钟内不褪色,即达滴定终点。
(1)醋酸为弱酸,部分电离,则醋酸在水溶液中的电离方程式为CH3COOHCH3COO-+H+;故答案为:CH3COOHCH3COO-+H+;
(2)①0.1mol·L-1的醋酸溶液的pH>1,0.1mol·L-1的盐酸的pH=1,观察滴定曲线的起点可以确定滴定醋酸的曲线是Ⅰ;
故答案为:Ⅰ;
②0.1mol·L-1的醋酸的电离度为1%,由CH3COOHCH3COO-+H+可知溶液中c(H+)=0.1mol·L-1×1%=0.001mol·L-1,所以醋酸溶液的pH=3;
故答案为:3;
③酸或碱会抑制水的电离,醋酸是弱酸,其电离出的氢离子浓度远小于同浓度的氢氧化钠溶液中的氢氧根离子浓度和盐酸中氢离子浓度,所以醋酸对水的电离的抑制作用较小,其中由水电离出的c(H+)最大;
故答案为:0.1mol·L-1醋酸溶液;
④A. 用标准NaOH溶液润洗碱式滴定管后,再装入标准碱溶液,操作正确,故A正确;
B. 用待测酸溶液润洗锥形瓶后,再装入待测酸溶液,会造成测得的酸溶液浓度偏大,不能用待测酸溶液润洗锥形瓶,用蒸馏水洗净锥形瓶后,直接装入待测酸溶液,故B错误;
C. 滴定时两眼应注视锥形瓶内溶液颜色的变化,以免滴定过量,故C错误;
D. 读数时,视线应与滴定管凹液面的最低点保持水平,故D正确;
故答案为:BC;
⑤由于石蕊的变色范围比较宽,且现象不明显,因此上述滴定绝不能用石蕊作指示剂,可选择酚酞或者甲基橙作指示剂,其中酚酞遇酸无色,遇碱变为红色,若使用酚酞作指示剂,则滴定终点的现象是:滴入最后一滴氢氧化钠溶液时,溶液颜色恰好由无色变为粉红色,且半分钟内不褪色,即达滴定终点;
故答案为:石蕊;滴入最后一滴氢氧化钠溶液时,溶液颜色恰好由无色变为粉红色,且半分钟内不褪色,即达滴定终点。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量 NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液 b.CH3COONa 溶液 c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+) c(CH3COO-) (填“>”、“<”或“=”);