题目内容
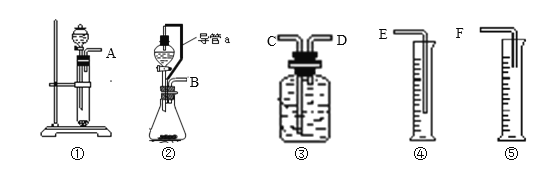
【题目】现有如下药品和装置:mg锌片、铁片、稀硫酸、水,设计一个实验,测定锌的相对原子质量(实验是在通常状况下进行的)。请完成下列实验:
(1)写出该反应的化学方程式 。
(2)所选用装置的连接顺序为(填接口字母) 。
(3)取Wg纯铁片与稀硫酸反应测得生成气体V1mL,该步骤的目的是 。
(4)实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
A.待实验装置冷却后再读数
B.上下移动量筒④,使其中液面与广口瓶中液面相平
C.上下移动量筒⑤,使其中液面与广口瓶中液面相平
D.视线与凹液面的最低点水平读取量筒中水的体积
(5)mg锌片与稀硫酸反应测得生成气体V2mL,则Zn的相对原子质量的数学表达式为 (用上述字母表示)。
(6)假设锌片中含不与酸反应的杂质,实验测得锌的相对原子质量可能比真实值(填“偏大”、“偏小”或“不变”,下同) ;实验结束时,仰视量筒读数,测得值 。
【答案】1)Zn+H2SO4=ZnSO4+H2↑(2分)(2)BDCE(3分)
(3)测定该条件下气体摩尔体积(其它合理答案也可)(2分)(4)ABD(3分)
(5)56V1m/V2W(3分)(6)偏大、偏大(1分+1分)
【解析】
试题分析:(1)发生的反应即锌和稀硫酸的反应,化学方程式为Zn + H2SO4=ZnSO4+H2↑;
(2)将稀硫酸与锌片在②中充分反应,产生的氢气从B通入D,通过C将集气瓶中的水排入量筒中,通过测量排出的水的量来得知产生氢气的量,故装置的连接顺序为BDCE;
(3)由于不是标准状况下,则需要测定该条件下的气体摩尔体积,即实验目的是测定该条件下气体摩尔体积;
(4)要准确测量气体体积必须保持量筒内外气体的温度和压强相等,因此在读取量筒内气体的体积之前,应使试管和量筒内的气体都冷却至室温;再调节量筒内外液面高度使之相同,所以正确的为ABD;
(5)该条件下气体摩尔体积为![]() ,mg锌片与稀硫酸反应测得生成气体V2mL,则
,mg锌片与稀硫酸反应测得生成气体V2mL,则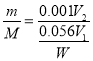 ,解得Zn的相对原子质量的数学表达式为56V1m/V2W。
,解得Zn的相对原子质量的数学表达式为56V1m/V2W。
(6)假如锌片含不与酸反应的杂质,则测得生成的氢气的体积V偏小,则测量值偏高;实验结束时,仰视量筒读数,读数偏小,测得值偏高.