题目内容
【题目】向一定量 4%的氢氧化钠溶液中逐滴加入稀盐酸,有关分析不正确的是
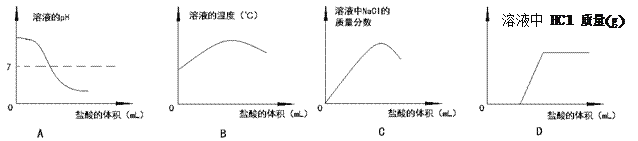
A. A B. B C. C D. D
【答案】D
【解析】A.开始时氢氧化钠溶液是碱性,pH大于7,随着稀盐酸的滴加,pH逐渐减小,但稀盐酸过量时pH小于7,故A正确;B.酸碱中和反应会放出热量,故随着稀盐酸的加入,溶液的温度升高,当恰好完全中和时,溶液温度最高,继续滴加稀盐酸,溶液的温度就会降低,故B正确;C.没有滴加稀盐酸时,溶液中氯化钠的质量分数为零,随着加入稀盐酸生成的氯化钠越来越多,溶液中氯化钠的质量分数越来越大,当二者完全中和时,溶液中氯化钠的质量分数达到最大值且不再增加,再滴加稀盐酸,溶液的质量增大,氯化钠的质量不变,溶液中氯化钠的质量分数减小,故C正确;D.当加入的稀盐酸与氢氧化钠发生反应时,HCl的物质的量为零,当二者恰好完全反应时,继续滴加稀盐酸,HCl的物质的量增加,且随着稀盐酸加入的量的增多,而不断增大,故D错误;故选D。

 名校课堂系列答案
名校课堂系列答案【题目】
元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1—36号元素),与中学常见的长式元素周期表相比,第一到第十八可看成族,k为Fe元素。试根据扇形周期表已填入元素回答问题:

(1)c的基态原子中,核外存在______对自旋相反的电子。元素x与g同族且比g多三个电子层,元素x的价电子排布式为____________。
(2)e、f、g的第一电离能由大到小的顺序为________(用元素符号表示)。
(3)d与j所形成的某种化合物固态时通常以三聚体的环状形式存在,如下图所示,其中j的原子杂化方式为_________。

(4)b和d所形成的一种三原子分子与c和d形成的一种化合物互为等电子体,则满足上述条件的c和d形成的化合物的化学式是__________________。
(5)b和h的有关化学键键能如下表所示,简要分析和解释下列有关事实:
化学键 | b-b | b-a | b-b | h-a |
键能/kj·mol-1 | 356 | 413 | 226 | 318 |
b与a形成化合物的种类远大于h与a形成化合物的种类,从能量的角度分析原因_____________。
(6)下图为e与x所形成的合金立方晶系晶胞图,晶胞棱长为748.8pm。

①若把一类金属原子全部抽掉,剩余的金属原子与扇形周期表中哪种已填入元素形成的单质晶型相同,该单质名称为___________。
②原子坐标参数,表示晶胞内部各原子的相对位置。其中坐标参数A处x为(0,0,0);B处e为(0,0, ![]() );C处x坐标为(
);C处x坐标为(![]() ,
, ![]() ,0)。则D处x的坐标参数为___________。
,0)。则D处x的坐标参数为___________。
③该晶体的密度计算式为___________g/cm3(已知x的相对原子质量为204)