题目内容
某碱式碳酸铜粉末加热可分解:Cu2(OH)2CO3?H2O
2CuO+CO2+(x+1)H2O.现取适量(不称量其质量)该固体样品,完成下列实验.
Ⅰ:测定该样品组成中结晶水x的值
用图示仪器组装装置完成实验Ⅰ(加热、支持、连接等仪器在图中略去,仪器可重复使用).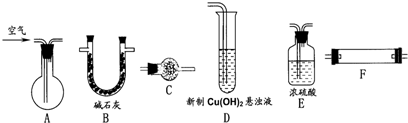
(1)组装仪器按气流方向从左到右连接的顺序为:A→ → → → →C.
(2)干燥管C应装有 (试剂),作用是 ;如果缺少C装置,测得的x的值会 (填“偏大”、“偏小”或“无法确定”).
Ⅱ:用实验Ⅰ分解后的残留固体完成乙醇的催化氧化实验,并验证其反应产物(已知乙醛和葡萄糖有相似的性质,检验方法相同).
选用上述仪器也按气流方向从左到右连接的顺序为:A→B→F→C→D
(3)A中应装有 (试剂);C用于检验反应产物之一,C中应装有 (试剂).
(4)要检验另一种反应产物,接下来的实验操作和现象是 .
| ||
Ⅰ:测定该样品组成中结晶水x的值
用图示仪器组装装置完成实验Ⅰ(加热、支持、连接等仪器在图中略去,仪器可重复使用).

(1)组装仪器按气流方向从左到右连接的顺序为:A→
(2)干燥管C应装有
Ⅱ:用实验Ⅰ分解后的残留固体完成乙醇的催化氧化实验,并验证其反应产物(已知乙醛和葡萄糖有相似的性质,检验方法相同).
选用上述仪器也按气流方向从左到右连接的顺序为:A→B→F→C→D
(3)A中应装有
(4)要检验另一种反应产物,接下来的实验操作和现象是
分析:(1)测定样品组成中的结晶水,不称量样品质量,需要装置中的空气全部除净,利用B除去二氧化碳和水蒸气的空气赶净装置中的空气,在F装置中加热碱式碳酸铜受热分解,用浓硫酸吸收生成的水蒸气测定质量,用B装置吸收生成的二氧化碳,称量质量得到二氧化碳的量,为防止空气中的二氧化碳和水蒸气进入B装置,需要最后接C装置;
(2)依据上述分析可知,干燥管C应装碱石灰,防止空气中的二氧化碳和水蒸气进入B装置,若缺少C,装置B中二氧化碳质量增大,计算得到水的物质的量减小,测定结果偏低;
(3)选用上述仪器也按气流方向从左到右连接的顺序为:A→B→F→C→D,用实验Ⅰ分解后的残留固体氧化铜完成乙醇的催化氧化实验,并验证其反应产物乙醛;A中应是乙醇产生乙醇蒸气,通过B装置除去水蒸气,通过F装置和氧化铜反应生成乙醛和水,通过装置C检验水蒸气的存在,所以C中装无水硫酸铜固体;
(4)通过装置D加热到沸腾反应,依据生成氧化亚铜红色沉淀证明乙醛的生成;
(2)依据上述分析可知,干燥管C应装碱石灰,防止空气中的二氧化碳和水蒸气进入B装置,若缺少C,装置B中二氧化碳质量增大,计算得到水的物质的量减小,测定结果偏低;
(3)选用上述仪器也按气流方向从左到右连接的顺序为:A→B→F→C→D,用实验Ⅰ分解后的残留固体氧化铜完成乙醇的催化氧化实验,并验证其反应产物乙醛;A中应是乙醇产生乙醇蒸气,通过B装置除去水蒸气,通过F装置和氧化铜反应生成乙醛和水,通过装置C检验水蒸气的存在,所以C中装无水硫酸铜固体;
(4)通过装置D加热到沸腾反应,依据生成氧化亚铜红色沉淀证明乙醛的生成;
解答:解:(1)测定样品组成中的结晶水,不称量样品质量,需要装置中的空气全部除净,利用B除去二氧化碳和水蒸气的空气赶净装置中的空气,在F装置中加热碱式碳酸铜受热分解,用浓硫酸吸收生成的水蒸气测定质量,用B装置吸收生成的二氧化碳,称量质量得到二氧化碳的量,为防止空气中的二氧化碳和水蒸气进入B装置,需要最后接C装置,组装仪器按气流方向从左到右连接的顺序为ABFEBC;
故答案为:BFEB;
(2)依据上述分析可知,干燥管C应装碱石灰,防止空气中的二氧化碳和水蒸气进入B装置,若缺少C,装置B中二氧化碳质量增大,计算得到水的物质的量减小,测定结果偏低;
故答案为:碱石灰,防止空气中的水蒸气和CO2进入B中,偏小;
(3)选用上述仪器也按气流方向从左到右连接的顺序为:A→B→F→C→D,用实验Ⅰ分解后的残留固体氧化铜完成乙醇的催化氧化实验,并验证其反应产物乙醛;A中应是乙醇产生乙醇蒸气,通过B装置除去水蒸气,通过F装置和氧化铜反应生成乙醛和水,通过装置C检验水蒸气的存在,所以C中装无水硫酸铜固体;
故答案为:乙醇,无水硫酸铜;
(4)通过装置D加热到沸腾反应,依据生成氧化亚铜红色沉淀证明乙醛的生成,将试管D加热至沸,出现砖红色沉淀证明乙醛被氢氧化铜氧化为氧化亚铜砖红色(或红色)沉淀;
故答案为:将试管D加热至沸,出现砖红色(或红色)沉淀;
故答案为:BFEB;
(2)依据上述分析可知,干燥管C应装碱石灰,防止空气中的二氧化碳和水蒸气进入B装置,若缺少C,装置B中二氧化碳质量增大,计算得到水的物质的量减小,测定结果偏低;
故答案为:碱石灰,防止空气中的水蒸气和CO2进入B中,偏小;
(3)选用上述仪器也按气流方向从左到右连接的顺序为:A→B→F→C→D,用实验Ⅰ分解后的残留固体氧化铜完成乙醇的催化氧化实验,并验证其反应产物乙醛;A中应是乙醇产生乙醇蒸气,通过B装置除去水蒸气,通过F装置和氧化铜反应生成乙醛和水,通过装置C检验水蒸气的存在,所以C中装无水硫酸铜固体;
故答案为:乙醇,无水硫酸铜;
(4)通过装置D加热到沸腾反应,依据生成氧化亚铜红色沉淀证明乙醛的生成,将试管D加热至沸,出现砖红色沉淀证明乙醛被氢氧化铜氧化为氧化亚铜砖红色(或红色)沉淀;
故答案为:将试管D加热至沸,出现砖红色(或红色)沉淀;
点评:本题考查了实验探究物质反应产物的组成满屋子性质的实验设计方法和仪器连接方法和原则,掌握物质性质和实验基本操作是解题关键,题目难度中等.

练习册系列答案
相关题目
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是???????????? ;
②反应A后调节溶液的pH范围应为?????????????????????????? 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净????????????????????? 。
④造成蓝绿色产品中混有CuO杂质的原因是???????????????????? 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
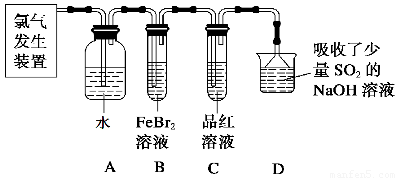
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有??? ????????? ????? 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 ????????? ?? 。此时B装置中发生反应的离子方程式是___________?????????????? _____。
③写出A溶液中具有强氧化性微粒的化学式????????? ??????????????????? ?? 。若向A溶液中加入NaHCO3粉末,会观察到的现象是????????????????????? 。

 ,在加热的条件下,反应为
,在加热的条件下,反应为 2CuO+
2CuO+ ↑+(x+1)
↑+(x+1) ,某同学粗略取一定样品,先后进行两个实验:实验(Ⅰ):测定
,某同学粗略取一定样品,先后进行两个实验:实验(Ⅰ):测定
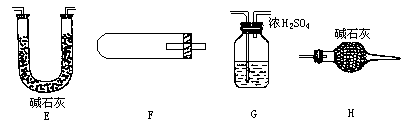
 (F装置连同药品反应前后的质量差,取正值,下同)、
(F装置连同药品反应前后的质量差,取正值,下同)、 ,为求x,这几个数据可用的是________,它们的组合有________种.
,为求x,这几个数据可用的是________,它们的组合有________种.