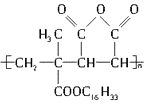
题目内容
【题目】根据题意解答
(1)某同学为探究元素周期表中同周期元素性质的递变规律,设计了如下系列实验. (i)将钠、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应产生的气体最多.
(ii)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 .
(2)利用如图装置可验证同主族元素非金属性的变化规律 
(i)干燥管D的作用是 .
(ii)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4 , (KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
(iii)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有溶液的洗气瓶.
【答案】
(1)钠;铝;S2﹣+Cl2═S↓+2Cl﹣
(2)防止溶液倒吸;变蓝;NaOH;有白色沉淀生成;饱和NaHCO3
【解析】解:(1)(i)同周期从左向右,随着原子序数的递增,元素的金属性逐渐减弱,钠、镁、铝属于同一周期,且原子序数逐渐增大,或根据金属活动性顺序表金属活泼性顺序可知:金属活泼性:钠>镁>铝,所以相同条件下与盐酸反应最激烈的是钠,反应速率最慢的是铝;生成1mol氢气需要得到2mol电子,1mol钠都失去1mol电子,1mol镁失去2mol电子,而1mol铝失去3mol电子,所以生成氢气最多的是金属铝,故答案为:钠;铝; (ii)氯气氧化性强于硫单质,所以氯气能够与硫离子反应生成硫,反应的离子方程式为:S2﹣+Cl2═S↓+2Cl﹣ , 故答案为:S2﹣+Cl2═S↓+2Cl﹣ . (2)(i)球形干燥管D球形部分具有较大空间,能起缓冲作用,能够防止倒吸,可以避免C中液体进入锥形瓶中, 故答案为:防止溶液倒吸;(ii)KMnO4与浓盐酸反应生成氯气,2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,氯气与淀粉碘化钾混合溶液反应生成碘单质,反应离子方程式为:2I﹣+Cl2═I2+2Cl﹣ , 碘遇淀粉试液变蓝色,故C中溶液变为蓝色;过量的氯气会逸散到空气中,污染环境,可用NaOH溶液吸收,反应离子方程式为:2OH﹣+Cl2═Cl﹣+ClO﹣+H2O,故答案为:变蓝;NaOH;(iii)因碳酸比硅酸强,二氧化碳可与硅酸钠反应生成硅酸沉淀,溶液变浑浊,氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和C之间增加装有饱和NaHCO3溶液的洗气瓶,
故答案为:有白色沉淀生成;饱和NaHCO3溶液.
(1)(i)根据同周期元素性质的递变规律或金属活动性顺序表可以判断钠、镁、铝的活泼性,活泼性越强,与盐酸反应越剧烈;根据电子守恒比较生成氢气体积大小;(ii)硫离子被氯气氧化成硫单质,据此写出反应的离子方程式.(2)(i)球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中;(ii)A盛放浓盐酸,B盛放高锰酸钾,AB为氯气的发生装置,C为氯气与淀粉碘化钾混合溶液反应装置,D为防倒吸装置,缺少尾气处理装置.氯气具有强氧化性,能将碘离子氧化为碘单质,碘遇淀粉试液变蓝色;氯气有毒,不能直接排空,可以用NaOH溶液吸收;(iii)盐酸酸性强于碳酸,二氧化碳能使石灰水变浑浊;盐酸挥发,应排除实验中干扰.

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】二氧化碳是全球气候变化的主要罪魁祸首,为消除二氧化碳的污染并使其转变为有用物质,全世界的化学科学家做了大量的研究.科学家找到了一种名叫二硒化钨的金属化合物,通过处理,在阳光作用下,使二氧化碳较易分解成一氧化碳和氧气,用一氧化碳可轻松获得多种能源物质.如CO和H2可以合成甲醇.
在10L的密闭容器中按物质的量之比1:2充入CO和H2 , 若充有10molCO发生反应:CO(g)+2H2(g)CH3OH(g).
测得平衡时CO的转化率隨温度变化及压强的变化如图所示:
p2、T2时,n(CO)随时间的变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(CO)/mol | 10 | 7 | 5 | 5 |
(1)p2、T2时,0~lmin 内,平均速率ν(H2)=mol/(Lmin);
(2)你认为p1p2(填“<”“>”或“=”)
(3)合成甲醇的反应为(填“放热”或“吸热”)反应.A、B、C三点的平衡常数KA、KB、KC的大小关系为 .
(4)若工业生产CH3OH,下列措施中,能增加单位时间内CH3OH产量的方法有 .
①增大压强 ②降低温度 ③升高温度
④加入催化剂 ⑤适当增大一氧化碳的比例量 ⑥及时分离CH3OH
(5)己知碳的燃烧热为Q1kJ/mol,碳与氧气反应生成一氧化碳(按量筒整数比)的反应热为﹣Q2J/mol,则二氧化碳在二硒化钨作催化剂时分解的热化学方程式(按最简整数比)为: .
【题目】下列检验方法与结论相符的一组是( )
序号 | 检 验 方 法 | 结 论 |
A | 向一种未知溶液中滴加AgNO3溶液,有白色沉淀 | 未知溶液中一定含有Cl﹣ |
B | 向一种未知溶液中滴加盐酸,有气泡产生 | 未知溶液中一定含有CO |
C | 将一种未知气体通入品红溶液,溶液褪色,加热后又恢复红色 | 未知气体是SO2 |
D | 向一种未知溶液中滴加BaCl2溶液,有白色沉淀 | 未知溶液中一定含有SO |
A.A
B.B
C.C
D.D