题目内容
 如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制100mL 1mol?L-1的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制100mL 1mol?L-1的稀盐酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:(1)配制稀盐酸时,还缺少的仪器有
100mL容量瓶
100mL容量瓶
(写出仪器名称及规格);(2)经计算,配制100mL1mol?L-1的稀盐酸需要用量筒量取上述浓盐酸的体积为
8.5
8.5
mL,量取盐酸时应选用10
10
mL(选填10mL、50mL、100mL)规格的量筒;(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol?L-1,引起误差的原因可能是
CD
CD
.A.定容时俯视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.转移溶液后,未洗涤烧杯和玻璃棒
D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线
(4)若将30mL 1mol?L-1盐酸与4.2gNaHCO3充分反应,在标准状况下可得多少升CO2(写出化学方程式和计算过程).
分析:(1)100mL 1mol?L-1的稀盐酸需要的仪器有:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,据此解答;
(2)根据c=
计算浓盐酸的物质的量浓度,根据稀释定律,稀释前后溶质硫酸的物质的量不变,据此计算需要浓盐酸的体积;
根据浓盐酸的体积选择量筒的规格;
(3)分析操作对溶质物质的量、溶液体积的影响,根据c=
判断对溶液浓度的影响;
(4)发生HCl+NaHCO3=NaCl+H2O+CO2↑,进行过量计算,根据不足的物质计算二氧化碳的物质的量,再根据V=nVm计算二氧化碳的体积.
(2)根据c=
| 1000ρω |
| M |
根据浓盐酸的体积选择量筒的规格;
(3)分析操作对溶质物质的量、溶液体积的影响,根据c=
| n |
| V |
(4)发生HCl+NaHCO3=NaCl+H2O+CO2↑,进行过量计算,根据不足的物质计算二氧化碳的物质的量,再根据V=nVm计算二氧化碳的体积.
解答:解:(1)100mL 1mol?L-1的稀盐酸需要的仪器有:量筒、烧杯、玻璃棒、100mL容量瓶、胶头滴管,故还缺少100mL容量瓶,
故答案为:100mL容量瓶;
据此解答;
(2)该浓盐酸的物质的量浓度为
mol/L=11.8mol/L,根据稀释定律,稀释前后溶质硫酸的物质的量不变,令需要钠元素的体积为V,则:
100mL×1mol/L=V×11.8mol/L
解得:V=8.5mL
故选择10mL的量筒,
故答案为:8.5,10;
(3)A.定容时俯视容量瓶刻度线,液面在刻度线以下,溶液的体积偏小,所配溶液的浓度偏大,故A不符合;
B.配制需加水定容,容量瓶在使用前未干燥,里面有少量蒸馏水,对所配溶液浓度无影响,故B不符合;
C.转移溶液后,未洗涤烧杯和玻璃棒,少量HCl沾在烧杯内壁和玻璃棒上,移入容量瓶中HCl的物质的量偏小,所配溶液浓度偏小,故C符合;
D.定容摇匀后发现液面低于容量瓶的刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至刻度线,溶液体积偏大,所配溶液浓度偏小,故D符合;
故选CD;
(4)n(HCl)=0.030L×1mol?L-1=0.03mol,n(NaHCO3 )=
=0.05mol,令0.05mol碳酸氢钠完全反应需要HCl的物质的量为xmol,则:
HCl+NaHCO3=NaCl+H2O+CO2↑
1 1
xmol 0.05mol
故x=0.05mol,由于0.05mol>0.03mol,故HCl不足,NaHCO3过量,根据HCl计算生成二氧化碳,由方程式可知0.03molHCl反应生成二氧化碳的物质的量为0.03mol,故生成的二氧化碳的体积为0.03mol×22.4L/mol=0.672L,
答:生成的二氧化碳的体积为0.672L.
故答案为:100mL容量瓶;
据此解答;
(2)该浓盐酸的物质的量浓度为
| 1000×1.18×36.5% |
| 36.5 |
100mL×1mol/L=V×11.8mol/L
解得:V=8.5mL
故选择10mL的量筒,
故答案为:8.5,10;
(3)A.定容时俯视容量瓶刻度线,液面在刻度线以下,溶液的体积偏小,所配溶液的浓度偏大,故A不符合;
B.配制需加水定容,容量瓶在使用前未干燥,里面有少量蒸馏水,对所配溶液浓度无影响,故B不符合;
C.转移溶液后,未洗涤烧杯和玻璃棒,少量HCl沾在烧杯内壁和玻璃棒上,移入容量瓶中HCl的物质的量偏小,所配溶液浓度偏小,故C符合;
D.定容摇匀后发现液面低于容量瓶的刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至刻度线,溶液体积偏大,所配溶液浓度偏小,故D符合;
故选CD;
(4)n(HCl)=0.030L×1mol?L-1=0.03mol,n(NaHCO3 )=
| 4.2g |
| 84g/mol |
HCl+NaHCO3=NaCl+H2O+CO2↑
1 1
xmol 0.05mol
故x=0.05mol,由于0.05mol>0.03mol,故HCl不足,NaHCO3过量,根据HCl计算生成二氧化碳,由方程式可知0.03molHCl反应生成二氧化碳的物质的量为0.03mol,故生成的二氧化碳的体积为0.03mol×22.4L/mol=0.672L,
答:生成的二氧化碳的体积为0.672L.
点评:考查一定物质的量浓度溶液的配制、过量计算等,难度中等,注意过量计算的格式,根据c=
理解溶液配制原理.
| n |
| V |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
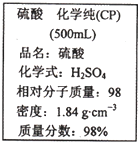 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法错误的是( )| A、该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | B、取10 mL该硫酸于烧杯中,再加等体积的水,可配得49%的硫酸 | C、配制200mL4.6 mol?L-1的稀硫酸需取该硫酸50mL | D、该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2 mol?L-1 |
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是( )
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法不正确的是( )
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此下列说法不正确的是( ) 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制100mL 1mol?L-1的稀硫酸.