题目内容
现拟用图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量

(1)制备一氧化碳的化学方程式是 ;
(2)试验中,观察到反应管中发生的现象是 ;尾气的主要成分是 ;
(3)反应完成后,正确的操作顺序为 (填字母)
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为 ;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节) ;
②写出有关反应的化学方程式 .

(1)制备一氧化碳的化学方程式是 ;
(2)试验中,观察到反应管中发生的现象是 ;尾气的主要成分是 ;
(3)反应完成后,正确的操作顺序为 (填字母)
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为 ;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节) ;
②写出有关反应的化学方程式 .
(1)HCOOH CO↑+H2O(2)样品由黑色变红色;CO、CO2(3)cab(4)80%(5)将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;CuO+H2SO4=CuSO4+H2O
CO↑+H2O(2)样品由黑色变红色;CO、CO2(3)cab(4)80%(5)将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;CuO+H2SO4=CuSO4+H2O
 CO↑+H2O(2)样品由黑色变红色;CO、CO2(3)cab(4)80%(5)将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;CuO+H2SO4=CuSO4+H2O
CO↑+H2O(2)样品由黑色变红色;CO、CO2(3)cab(4)80%(5)将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;CuO+H2SO4=CuSO4+H2O(1)甲酸在浓硫酸、加热的条件下分解生成CO与H2O;
(2)实验中,反应管中发生反应CuO+CO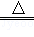 Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
(3)实验步骤:先通入CO一会儿后,加热待反应管内的药品完全后,停止加热,然后继续通入CO到玻璃管冷却为止;
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,剩余固体全部为铜,利用差量法计算出原样品中氧化铜的质量,进而计算铜的质量分数;
(5)①要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可.②反应的化学方程式为CuO+H2SO4=CuSO4+H2O.
解:(1)甲酸在浓硫酸、加热的条件下分解生成CO与H2O,反应方程式为HCOOH CO↑+H2O;
CO↑+H2O;
故答案为:HCOOH CO↑+H2O;
CO↑+H2O;
(2)实验中,反应管中发生反应CuO+CO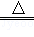 Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
故答案为:样品由黑色变红色;CO、CO2;
(3)反应完后,操作顺序先撤酒精灯2,此时左边装置仍在制取CO,然后再关闭分液漏斗的开关,不再加入反应试剂,最后撤酒精灯1停止反应,这样操作防止空气中O2进入右边装置铜又被氧化为氧化铜了,正确的操作顺序为:熄灭酒精灯2,关闭漏斗开关,最后熄灭酒精1,即cab;
故答案为:cab;
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,剩余固体全部为铜,令样品中CuO的质量为m,则:
CuO+CO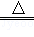 Cu+CO2,固体质量减少△m
Cu+CO2,固体质量减少△m
80 16
m 5g﹣4.8g=0.2g
故m= ×0.2g=1g,
×0.2g=1g,
所以原样品中金属铜的质量分数为 ×100%=80%;
×100%=80%;
故答案为:80%;
(5)①要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;
故答案为:将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;
②反应的化学方程式为CuO+H2SO4=CuSO4+H2O;
故答案为:CuO+H2SO4=CuSO4+H2O.
点评:本题考查学生对实验原理与实验操作的理解、实验方案设计、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.
(2)实验中,反应管中发生反应CuO+CO
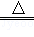 Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;(3)实验步骤:先通入CO一会儿后,加热待反应管内的药品完全后,停止加热,然后继续通入CO到玻璃管冷却为止;
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,剩余固体全部为铜,利用差量法计算出原样品中氧化铜的质量,进而计算铜的质量分数;
(5)①要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可.②反应的化学方程式为CuO+H2SO4=CuSO4+H2O.
解:(1)甲酸在浓硫酸、加热的条件下分解生成CO与H2O,反应方程式为HCOOH
 CO↑+H2O;
CO↑+H2O;故答案为:HCOOH
 CO↑+H2O;
CO↑+H2O;(2)实验中,反应管中发生反应CuO+CO
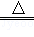 Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;
Cu+CO2,反应管中发生的现象是黑色粉末变红;尾气的主要成分是CO、CO2;故答案为:样品由黑色变红色;CO、CO2;
(3)反应完后,操作顺序先撤酒精灯2,此时左边装置仍在制取CO,然后再关闭分液漏斗的开关,不再加入反应试剂,最后撤酒精灯1停止反应,这样操作防止空气中O2进入右边装置铜又被氧化为氧化铜了,正确的操作顺序为:熄灭酒精灯2,关闭漏斗开关,最后熄灭酒精1,即cab;
故答案为:cab;
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,剩余固体全部为铜,令样品中CuO的质量为m,则:
CuO+CO
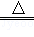 Cu+CO2,固体质量减少△m
Cu+CO2,固体质量减少△m80 16
m 5g﹣4.8g=0.2g
故m=
 ×0.2g=1g,
×0.2g=1g,所以原样品中金属铜的质量分数为
 ×100%=80%;
×100%=80%;故答案为:80%;
(5)①要测定铜的质量分数,可以把浓硫酸稀释,铜和稀硫酸不反应,氧化铜和稀硫酸反应,即可求出铜的质量分数.设计方案的主要步骤是将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;
故答案为:将浓硫酸用蒸馏水稀释,将样品与稀硫酸充分反应后,过滤,干燥,称量剩余固体铜的质量即可;
②反应的化学方程式为CuO+H2SO4=CuSO4+H2O;
故答案为:CuO+H2SO4=CuSO4+H2O.
点评:本题考查学生对实验原理与实验操作的理解、实验方案设计、元素化合物性质、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目


 (查尔酮)
(查尔酮)



 (3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(3)已知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
