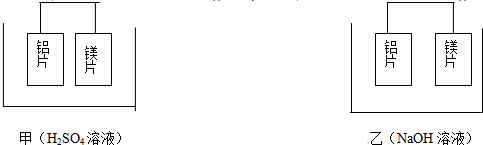题目内容
18.某有机物X,经燃烧分析实验测定,9.2g该物质完全燃烧,只生成10.8g H2O和8.96L CO2(标准状况),X的核磁共振氢谱图如下.下列有关X的说法中正确的是( )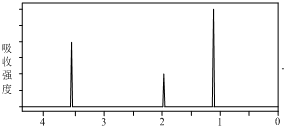
| A. | X只含C、H两种元素 | |
| B. | X含三种元素,其原子数之比为1:2:3 | |
| C. | 无法确定有机物X的分子式与结构式 | |
| D. | X的结构简式为CH3CH2OH |
分析 根据n=$\frac{m}{M}$计算出水、二氧化碳的物质的量,再根据质量守恒确定含有氧元素的质量及物质的量;根据C、H、O元素的物质的量之比得出该有机物达到最简式,根据有机物结构与性质及核磁共振氢谱的知识对各选项进行判断.
解答 解:将9.2g该有机物的完全燃烧产物通过浓硫酸,10.8g为水,其物质的量为:$\frac{10.8g}{18g/mol}$=0.6mol,含有H元素的物质的量为:0.6mol×2=1.2mol,质量为:1g/mol×1.2mol=1.2g,8.96L CO2(标准状况),其物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,原有机物中含有C的质量为:12g/mol×0.4mol=4.8g,
该有机物中含有C、H元素的质量为:4.8g+1.2g=6g<9.2g,所以该有机物分子中含有氧元素,含有氧元素的物质的量为:$\frac{9.2g-6g}{16g/mol}$=0.2mol,
所以该有机物分子中C、H、O原子数之比为:0.4mol:1.2mol:0.2mol=2:6:1,其最简式为:C2H6O,根据成键理论,该式子即为分子式.
A.根据分析可知,该有机物含有C、H、O三种元素,故A错误;
B、该有机物分子中只含有C、H、O三种元素,C、H、O原子数之比为:0.4mol:1.2mol:0.2mol=2:6:1,故B错误;
C、得到的最简式C2H6O2中H原子已经达到饱和,所以该有机物分子式为C2H6O,故C错误;
D、该有机物分子式为C2H6O,根据核磁共振氢谱图,有机物中含有三种氢原子,个数之比是3:2:1,所以X的结构简式为CH3CH2OH,故D正确.
故选D.
点评 本题考查了有机物分子式的计算与判断,题目难度中等,注意掌握质量守恒在确定有机物分子式、结构简式中的应用方法,试题培养了学生的化学计算能力.

①加盐酸溶解 ②加入过量烧碱溶液 ③过滤 ④通入过量CO2生成Al(OH)3 沉淀⑤加入盐酸生成Al(OH)3沉淀.
| A. | ①②⑤③ | B. | ②③④③ | C. | ②③⑤③ | D. | ①③⑤③ |
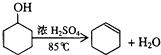
反应物与产物的物理性质:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
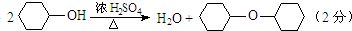 .
.(2)根据上述资料,装置(A,B,C)C最适宜用来完成本次制备实验.
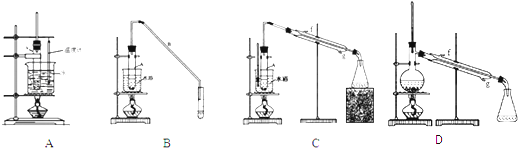
(3)制备粗产品
将5mL环己醇加入试管A中,再加入l0mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全.
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等.粗产品需依次经过水洗、加碳酸钠溶液洗涤以及第二次水洗.在此过程中加入碳酸钠溶液的目的是除去环己烯中少量酸性杂质;分液时,环己烯应从分液漏斗的上(填“上”或“下”)口取出.
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入图D所示装置的蒸馏烧瓶(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为85℃.
| A. | 在炭粉中加入KClO3,点燃时燃烧更为剧烈 | |
| B. | 锌与稀硫酸反应中加入少量CuSO4溶液而使反应放出H2的速率加快 | |
| C. | 双氧水中加入少量FeCl3,可加快放出气体的速率 | |
| D. | 固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀 |
| A. | 依据丁达尔现象可将分散系划分为溶液、胶体与浊液 | |
| B. | PM2.5(微粒直径约为2.5×10-6 m)分散在空气中形成气溶胶 | |
| C. | 光导纤维、聚乙烯、油脂都是高分子化合物 | |
| D. | 大雾的形成与汽车的尾气排放有很大关系 |
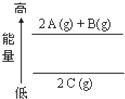
| A. | 2A(g)+B(g)=2 C(g)△H<0 | B. | 2A(g)+B(g)=2 C(g)△H>0 | C. | 2C(g)=2A(g)+B(g)△H>0 | D. | 2C(g)=2 A(g)+B(g)△H<0 |
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 稀硝酸和过量的铁屑反应:3 Fe+8H++2 NO3-=3 Fe3++2 NO↑+4 H2O | |
| D. | 大理石溶于醋酸的反应:CaCO3+CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| B. | 在常温常压下,11.2升氯气含有的分子数为0.5NA | |
| C. | 在常温常压下,1摩尔气体含有的原子数为NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数目相同 |