题目内容
【题目】500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
A.原混合溶液中c(K+)为2mol·L-1
B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5mol
D.电解后溶液中c(H+)为2mol·L-1
【答案】AB
【解析】
电解硝酸钾和硝酸铜混合溶液时,阳极上氢氧根离子放电生成氧气,阴极上先铜离子放电生成铜单质,当铜离子完全析出时,氢离子放电生成氢气,两阶段的化学方程式分别为2Cu2++2H2O![]() 2Cu+O2↑+4H+,2H2O
2Cu+O2↑+4H+,2H2O![]() 2H2↑+O2↑;气体的物质的量=
2H2↑+O2↑;气体的物质的量=![]() =1mol;每生成1mol氧气转移4mol电子,每生成1mol氢气转移2mol电子,每生成1mol铜转移2mol电子,所以根据转移电子守恒得铜的物质的量=
=1mol;每生成1mol氧气转移4mol电子,每生成1mol氢气转移2mol电子,每生成1mol铜转移2mol电子,所以根据转移电子守恒得铜的物质的量=![]() =1mol,则铜离子的物质的量浓度=
=1mol,则铜离子的物质的量浓度=![]() =2mol/L,根据电荷守恒得钾离子浓度=6molL-1-2mol/L×2=2mol/L,
=2mol/L,根据电荷守恒得钾离子浓度=6molL-1-2mol/L×2=2mol/L,
A.根据分析知,原混合溶液中c(K+)为2molL-1,故A正确;
B.转移电子的物质的量=1mol×4=4mol,故B正确;
C.根据以上分析知,铜的物质的量为1mol,故C错误;
D.第一阶段才有H+产生,第一阶段转移了2mol电子,产生的H+的物质的量为2mol,电解后溶液中c(H+)为:![]() =4mol/L,故D错误;
=4mol/L,故D错误;
故选:AB。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
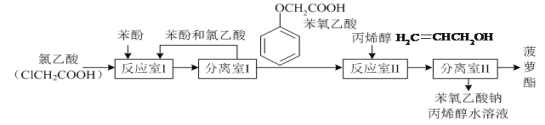
单元加期末复习先锋大考卷系列答案【题目】实验室模拟工业生产食品香精菠萝酯(![]() )的简易流程如图:
)的简易流程如图:
有关物质的熔、沸点如表:
苯酚 | 氯乙酸 | 苯氧乙酸 | |
熔点/℃ | 43 | 62 | 99 |
沸点/℃ | 181.9 | 189 | 285 |
试回答下列问题:
(1)反应室I中反应的最佳温度是104℃,为较好地控制温度在102℃~106℃之间,加热时可选用________(选填字母)。
A.火炉直接加热 B.水浴加热 C.油浴加热.
(2)分离室I采取的操作名称是__________。
(3)苯氧乙酸含氧官能团的名称__________。
(4)下列叙述错误的是_________。
A.反应室I产物中残留的苯酚可用FeCl3溶液检验
B.反应室Ⅱ产物中残留的丙烯醇可用溴水检验
C.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
D.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
(5)反应室I中发生反应的化学方程式是______。
(6)分离室Ⅱ的操作为:①用NaHCO3溶液洗涤后分液;②有机层用水洗涤后分液;洗涤时不能用NaOH溶液代替NaHCO3溶液,其原因是_______(用化学方程式表示)。