题目内容
【题目】(1)为清理路面积雪人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。该融雪剂的化学式是____________,该物质中化学键类型是___________,电子式是_________。
(2)已知A、B、C、D是中学化学中常见的四种不同粒子.它们之间存在如图所示的转化关系.
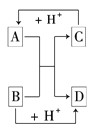
如果A、B、C、D均是10电子的粒子,请写出:A的结构式________,D的电子式________.
(3)下列说法正确的是 (填写字母序号) ____________
A.晶体中分子间作用力越大,分子越稳定
B. 分子晶体的熔沸点比较低
C.冰融化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未破坏
E.在离子化合物里,只存在离子键,没有共价键
F.任何分子中一定都存在化学键
G.在共价化合物分子内,一定不存在离子键
H.全部由非金属元素形成的化合物中不可能含有离子键
(4)下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ______
A.NaOH和NaCl B.CO2和H2
C.NaCl和HCl D.CCl4和KCl
【答案】 CaCl2 离子键 ![]()
![]() B G B
B G B
【解析】试题分析:XY2的阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子,所以X2+、Y-,都是18电子微粒,所以X是Ca元素、Y是Cl元素。
如果A、B、C、D均是10电子的粒子,结合10电子微粒进行分析判断;根据发生反应A+B=C+D,A、B、C、D均是10电子的粒子,可判断为:A、B分别为OH-、NH4+,C、D分别为NH3、H2O。又因为B和氢离子反应生成D,所以B是OH-,D是水,A是NH4+,C是氨气。
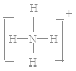
解析:(1)XY2的阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子,所以X2+、Y-,都是18电子微粒,所以X是Ca元素、Y是Cl元素,该融雪剂的化学式是CaCl2,CaCl2是离子化合物,化学键类型是离子键,电子式是![]() ;根据(2) NH4+的结构式
;根据(2) NH4+的结构式 ,H2O的电子式
,H2O的电子式![]() ;
;
(3)A.键能越大分子越稳定,化学键决定分子越稳定性,故A错误;B. 分子间作用力越大,分子晶体的熔沸点越高,故B正确;C.冰融化时分子间作用力被破坏,故C错误;D.氯化钠熔化时破坏离子键,故D错误;E.在离子化合物里,存在离子键,可能有共价键,故E错误;F.稀有气体没有化学键,故F错误;G.在共价化合物,只含有共价键,故G正确;H.全部由非金属元素形成的化合物氯化铵中含有离子键,故H错误。
(4)NaOH属于离子晶体,含有离子键、共价键; NaCl 属于离子晶体,含有离子键,故A错误; CO2属于分子晶体,含有共价键; H2 属于分子晶体,含有共价键,故B正确;NaCl 属于离子晶体,含有离子键;HCl属于分子晶体,含有共价键,故C错误;CCl4属于分子晶体,含有共价键;KCl属于离子晶体,含有离子键,故D错误;

 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案【题目】下表符号中“2”的含义正确的一组是( )
2H | 2He | 2Cl | Ca2+ | |
A | 质量数 | 中子数 | 质子数 | 电荷数 |
B | 质量数 | 质子数 | 原子个数 | 电荷数 |
C | 质子数 | 中子数 | 原子个数 | 电荷数 |
D | 质量数 | 质子数 | 中子数 | 电荷数 |
A.A
B.B
C.C
D.D