题目内容
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A.a-3=c+2 | B.质子数a>b>c>d |
| C.离子的还原性Y2-<Z- | D.离子半径X+< W3+< Y2-< Z- |
A
解析试题分析:元素的原子失去电子变为阳离子;元素的原子获得电子变为阴离子。A.aW3+和cY2-具有相同的电子层结构,所以a-3=c+2。正确。B.质子数a>b >d>c。错误。C.对于电子层结构相同的离子来说,离子所带的电荷越多,离子的还原性就越强。所以离子的还原性Y2->Z-。错误。D.对于电子层结构相同的微粒来说,核电荷数越大,离子的半径就越小。所以离子半径W3+<X+< Y2-< Z-。错误。
考点:考查电子层结构相同的微粒的比较的知识。

练习册系列答案
相关题目
以下有关原予结构及元素周期律的叙述正确的是
| A.同主族元素从上到下,单质的熔点逐渐降低 |
| B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小 |
| C.第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
| D.第IA族元素铯的两种同位素137Cs比133Cs多4个质子 |
元素周期表和元素周期律对与化学相关的科学技术具有指导作用,人们常在元素周期表中一定的区域内寻找特殊物质,其中寻找催化剂的区域为( )
| A.金属与非金属的分界线附近区域 | B.过渡元素区域 |
| C.氟、氯、硫、磷等元素附近区域 | D.元素周期表左下部分主族元素区域 |
已知a元素的阳离子,b元素的阴离子、c元素的阴离子具有相同的电子层结构,且b的阴离子半径大于c的阴离子半径,则其原子序数大小顺序为( )
| A.c>b>a | B.a>b>c | C.a>c>b | D.c>a>b |
X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是( )
| A.元素非金属性由弱到强的顺序为Z<Y<X |
| B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 |
| C.3种元素的气态氢化物中Z的气态氢化物最稳定 |
| D.原子半径由大到小的顺序为Z<Y<X |
XeF4在水中的反应为:6XeF4+12H2O==2XeO3+4Xe↑+24HF+3O2↑。下列说法中正确的是
| A.XeF4分子中各原子均达到8电子稳定结构 |
| B.XeF4分子中Xe的化合价为0价 |
| C.上述反应中氧化剂和还原剂的物质的量之比为2∶3 |
| D.XeF4按上述方式水解,每生成4molXe,转移16mol电子 |
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,Z和Y 组成原电池时,Z为电池的负极。X、Y、Z三种金属的活动性顺序为( )。
| A.X>Y>Z |
| B.X>Z>Y |
| C.Y>X>Z |
| D.Y>Z>X |
(6分)(2012?广东)如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )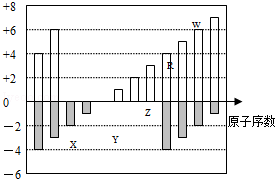
| A.原子半径:Z>Y>X |
| B.气态氢化物的稳定性:R>W |
| C.WX3和水反应形成的化合物是离子化合物 |
| D.Y和Z两者最高价氧化物对应的水化物能相互反应 |