题目内容
(1)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(CH3COO-) c(Na+)。(填大于、小于、等于)
(2)将pH=3的硫酸溶液和pH=12的氢氧化钠溶液混和,若使混和后溶液的pH=7,则硫酸溶液和氢氧化钠溶液的体积比是_______
(3)某酸性化工废水中含有浓度约为0.01mol.L-1的Ag+、Pb2+等重金属离子。有关数据如下:
(i)在废水排放前,用沉淀法除去这两种离子, 最好加入_________(填字母序号)
A. Na2S、 B. NaOH 、 C.KI、 D.Ca(OH)2
(ii)某工程师用CaO处理上述废水后Pb2+的浓度为1.2×10-3 则此溶液的pH=____。
(2)将pH=3的硫酸溶液和pH=12的氢氧化钠溶液混和,若使混和后溶液的pH=7,则硫酸溶液和氢氧化钠溶液的体积比是_______
(3)某酸性化工废水中含有浓度约为0.01mol.L-1的Ag+、Pb2+等重金属离子。有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A. Na2S、 B. NaOH 、 C.KI、 D.Ca(OH)2
(ii)某工程师用CaO处理上述废水后Pb2+的浓度为1.2×10-3 则此溶液的pH=____。
(10分)(1)酸性 大于(2)10:1(3)(i)A;(ii)8(每空2分)
试题分析:(1)醋酸为弱电解质,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合,醋酸过量,溶液呈酸性,则c(H+)>c(OH-),溶液中存在:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),则c(Na+)<c(CH3COO-)。
(2)pH=7溶液呈中性,即反应前n(H+)=n(OH-),故硫酸溶液和氢氧化钠溶液的体积比是10:1。
(3)(i)由表格中的溶度积数据可知,Ag2S和PbS的溶度积最小,则加入Na2S沉淀效果最好,故答案为:A。
(ii)Pb(OH)2的Ksp是1.2×10-15,Pb2+的浓度为1.2×10-3,故c(OH-)=1.0×10-6,PH=8。
点评:本题考查酸碱混合以及溶液PH的大小比较,题目难度中等,本题注意从溶液电中性的角度比较溶液离子浓度的大小关系,另外把握盐类水解的原理。

练习册系列答案
相关题目
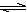 H++A2-。现有下列四种溶液:
H++A2-。现有下列四种溶液: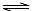 H2A+OH―
H2A+OH―