题目内容
(10分)一定温度时,在容积一定的密闭容器中,反应A(s)+B(g) C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
C(g)+D(g)达到平衡后,升高温度容器内气体的密度增大。请回答下列问题:
(1)正反应是 (填“放热”或“吸热”)反应;该反应的化学平衡常数的表达式是 。
(2)能判断该反应一定达到平衡状态的依据是 。(填写字母编号)
A. 体积分数组成C%=D%
B. 单位时间内生成n moAl的同时生成n molC
C. 温度和体积一定是,某一生成物浓度不再变化
D. 温度和体积一定是,容器内压强不再变化
(3)该反应的正反应速率随时间变化的关系如右图所示。
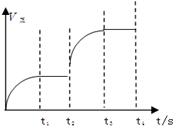
T2时改变了某种条件,改变的条件是 。(填写字母编号)
A.升温 B.加压 C.催化剂 D.增加A的量
(4)升高温度到T℃时,在一密闭容器中充入2mol A和3mol B,发生上述反应。平衡后测得K=1。然后在温度不变的情况下,扩大容器容积至原来的10倍,结果A的百分含量始终未改变,则此时B的转化率是 。
(1)吸热 K=[ c(C)·c(D)]/ c(B)
(2)BCD
(3)B
(4)40%
【解析】
试题分析:(1)升高温度容器内气体的密度增大,又容器的体积一定,因此,平衡向正反应方向移动,故正反应为吸热反应,其平衡常数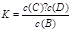 。
。
(2)体积分数组成C%=D%,不能判断反应达到平衡状态。反应达到平衡状态时,正反应速率与逆反应速率相等。
(3)由图像可知,改变条件后,正反应速率增大,且平衡向逆反应方向进行。符合此条件的为C增大压强。
(4)“扩大容器容积至原来的10倍,结果A的百分含量始终未改变”说明此时平衡不发生移动,则B的转化率保持不变。根据“三段式法”计算:设容器的体积为V
A(s)+B(g) C(g)+D(g)
C(g)+D(g)
起始(mol) 2 3 0 0
变化(mol) x x x x
平衡(mol) 2-x 3-x x x
 ,
, ,此时B的转化率为:
,此时B的转化率为: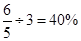
考点:化学平衡、平衡移动、平衡转化率的计算
点评:本题是对化学平衡的综合考查。对于平衡状态的确定,必须是正逆反应的反应速率相等,即达到平衡状态;对于平衡转化率的计算,应利用三段式法,可以使得计算过程较为有条理性。

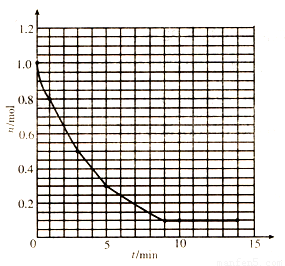
(8分)某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
|
t/min |
X/mol |
Y/mol |
Z/mol |
|
0 |
1.00 |
1.00 |
0.00 |
|
l |
0.90 |
0.80 |
0.20 |
|
3 |
0.75 |
0.50 |
0.50 |
|
5 |
0.65 |
0.30 |
0.70 |
|
9 |
0.55 |
0.10 |
0.90 |
|
10 |
0.55 |
0.10 |
0.90 |
|
14 |
0.55 |
0.10 |
0.90 |
(1)体系中发生反应的化学方程式是 ;
(2)列式并计算该反应在O-5min时间内产物Z的平均反应速率: ;
(3)该反应在第 分钟(min)时达到平衡状态;
(4)若使该反应的速率增加,下列措施一定不能达到目的的是 。
A.升高温度
B.降低温度
C.使用催化剂
D.保持容器体积不变加入lmolx和2moly
 PCl5(g)
反应达到平衡时容器的压强为开始时的6/7,则此时。
PCl5(g)
反应达到平衡时容器的压强为开始时的6/7,则此时。