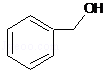题目内容
【题目】聚合物F的合成路线图如图: 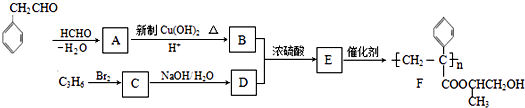
已知:HCHO+RCH2CHO→ 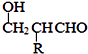
![]()
![]()
请据此回答:
(1)A中含氧官能团名称是 , C的系统命名为
(2)检验B中所含官能团所用的试剂有;E→F的反应类型是 .
(3)G物质的相对分子质量比 ![]() 的相对分子质量大2,则符合下列条件的G的同分异构体有种. ①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
的相对分子质量大2,则符合下列条件的G的同分异构体有种. ①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
(4)C生成D的反应化学方程式为 , 如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为
(5)参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备 ![]() 的合成路线
的合成路线
【答案】
(1)醛基;1,2﹣二溴丙烷
(2)碳酸氢钠溶液(或碳酸钠)、溴水;加聚反应
(3)3
(4)CH3CHBrCH2Br+2NaOH→CH3CH(OH)CH2OH+2NaBr;CH3C≡CH(写成CH2=C=CH2也给分)
(5)
【解析】解:(1)A为  ,其所含氧官能团为醛基,据F的结构简式可知,C3H6为丙烯,其与溴放出加成反应生成的C为1,2﹣二溴丙烷, 所以答案是:醛基;1,2﹣二溴丙烷;(2)B中含有的官能团为羧基和碳碳双键,用碳酸氢钠溶液检验羧基,用溴水检验碳碳双键,E为
,其所含氧官能团为醛基,据F的结构简式可知,C3H6为丙烯,其与溴放出加成反应生成的C为1,2﹣二溴丙烷, 所以答案是:醛基;1,2﹣二溴丙烷;(2)B中含有的官能团为羧基和碳碳双键,用碳酸氢钠溶液检验羧基,用溴水检验碳碳双键,E为  ,E通过加聚反应生成F,
,E通过加聚反应生成F,
所以答案是:碳酸氢钠溶液(或碳酸钠)、溴水;加聚反应;(3)G物质的相对分子质量比 ![]() 的相对分子质量大2,为苯乙醇,其同分异构体具备①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
的相对分子质量大2,为苯乙醇,其同分异构体具备①分子中含有苯环,且苯环上有两个取代基 ②遇氯化铁溶液变紫色
, 说明含有乙基和酚羟基,其由邻间对3种同分异构体,所以答案是:3.(4)C为1,2﹣二溴丙烷,其水解生成D,D为1,2﹣二羟基丙醇,反应的化学方程式为:CH3CHBrCH2Br+2NaOH→CH3CH(OH)CH2OH+2NaBr;C与氢氧化钠的水溶液发生消去反应生成丙炔或1,2﹣丙二烯,
所以答案是:CH3CHBrCH2Br+2NaOH→CH3CH(OH)CH2OH+2NaBr;CH3C≡CH(写成CH2=C=CH2也给分);(5)据已知反应可知,甲醛与乙醛发生羟醛缩合反应后失水生成CH2=CHCHO,然后用弱氧化剂新制氢氧化铜将醛基氧化为羧基,再与甲醇发生酯化反应生成CH2=CHCOOCH3 , 其发生加聚反应可得 ![]() ,具体流程为
,具体流程为  ,
,
所以答案是:  .
.

【题目】如图所示,X,Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( ) 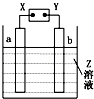
a极板 | b极板 | X电极 | Z | |
A | 锌 | 石墨 | 负极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 银 | 铁 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A.A
B.B
C.C
D.D
【题目】汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化: 2CO(g)+2NO(g)N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=﹣283kJmoL﹣1 . 几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | N |
键能kJ/mol﹣1 | 945 | 498 | 630 |
已知:N2(g)+O2(g)=2NO(g)△H3 , 则:△H1= .
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后电解质溶液中离子浓度大小顺序为 c(K+)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣),则负极的反应式为;
(3)在一定温度下,向2L的密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应 4CO(g)+2NO2(g)N2(g)+4CO2(g)△H<0,相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2) | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2) | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①5~10min,用CO的浓度变化表示的反应速率为:
②能说明上述反应达到平衡状态的是
A.2n正(NO2)=n逆(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变D.容器内气体压强不变
③20min时,向容器中加入1.0molNO2和1.0molCO,在t1时刻再次达到平衡时,NO2的转化率比原平衡时(填“变大”、“变小”或“不变”).
④计算此温度下的化学平衡常数K=
⑤在上述平衡的基础上,在时间t2、t3时改变反应的某一条件,反应速率的变化如图所示,则在t3时刻改变的反应条件是:;在时间15﹣20,t1﹣t2 , t2﹣t3 , t4﹣t5时的平衡常数分别为K1、K2、K3、K4 , 请比较各平衡常数的大小关系: .