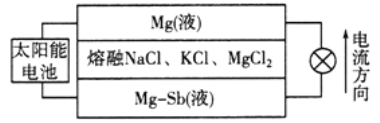
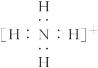题目内容
【题目】某小组探究“地康法制氯气”的原理并验证Cl2的性质,设计实验如下(夹持装置略去)请回答下列问题:
Ⅰ.Cl2的制备。
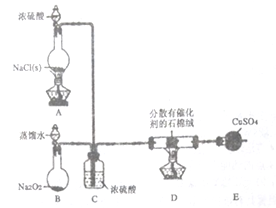
(1)装置B中发生反应的化学方程式为________________。
(2)装置C的作用除干燥气体外还有______________________。
(3)装置E中盛放CuSO4的仪器名称为___________;反应开始后,硫酸铜变蓝,则装置D中发生反应的化学方程式为________________。
Ⅱ.Cl2性质的验证。
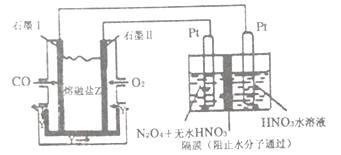
该小组用实验Ⅰ中制得的Cl2和如图所示装置(不能重复使用)依次验证干燥纯净的Cl2无漂白性、湿润的Cl2有漂白性、Cl的非金属性强于S
查阅资料:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物,同时,溶解度大的气体难逸出;
②少量CO2不干扰实验;
③该实验条件下,C与Cl2不反应。
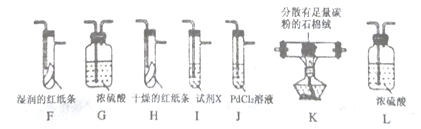
(4)按气流从左到右的方向,装置连接的合理顺序为
E→G→K→ → → → → →尾气处理(填装置字母)。_________
(5)试剂X的名称为_______________。
(6)装置J中发生反应的化学方程式为______________。
(7)设计实验证明经净化后的Cl2中不含HCl:________________。
【答案】2Na2O2+2H2O=4NaOH+O2 控制气体的流速和比例、使气体混合均匀 (球形)干燥管 4HC1+O2![]() 2H2O+ 2C12 JLHFI 硫化钠溶液 PdCl2+CO+H2O=Pd+CO2+2HCl 将净化后的混合气体通入足量CCl4,再通过湿润的蓝色石蕊试纸,试纸不变红(或将净化后的混合气体通入足量CCl4,再通入AgNO3溶液,无白色沉淀生成),则证明净化后的Cl2中不含HC1
2H2O+ 2C12 JLHFI 硫化钠溶液 PdCl2+CO+H2O=Pd+CO2+2HCl 将净化后的混合气体通入足量CCl4,再通过湿润的蓝色石蕊试纸,试纸不变红(或将净化后的混合气体通入足量CCl4,再通入AgNO3溶液,无白色沉淀生成),则证明净化后的Cl2中不含HC1
【解析】
试题Ⅰ.(1)装置B中过氧化钠与水反应放出氧气;(2)根据装置C中的气泡可以判断并控制气体流速,氯化氢、氧气在装置C中能混合均匀;(3)根据装置图回答;水能使硫酸铜变蓝,硫酸铜变蓝,可知装置D中氯化氢与氧气生成水和氯气;Ⅱ.E出来的气体含有氧气、氯气、氯化氢,通过K后氧气与碳反应生成CO,通过J中PdCl2溶液捕获CO后剩余氯气、二氧化碳;通过L进行干燥,通过干燥的红纸条证明干燥的Cl2无漂白性、通过湿润的红纸条证明湿润的Cl2有漂白性、通过装置J证明Cl的非金属性强于S;(5)氯气与硫化钠溶液反应生成淡黄色硫沉淀,可以证明Cl的非金属性强于S;(6)PdCl2溶液捕获CO时,生成金属单质Pd和两种酸性气体化合物CO2、HCl。(7)氯气易溶于CCl4、HC1不溶于CCl4,气体通过CCl4后,再通入AgNO3溶液,若无白色沉淀生成,则证明净化后的Cl2中不含HC1。
解析:Ⅰ.(1)装置B中过氧化钠与水反应放出氧气,反应方程式是2Na2O2+2H2O=4NaOH+O2![]() ;(2)根据装置C中气泡溢出的速度可以判断并控制气体流速,氯化氢、氧气在装置C中能混合均匀;(3)装置E是球形干燥管;水能使硫酸铜变蓝,硫酸铜变蓝,可知装置D中氯化氢与氧气生成水和氯气,反应方程式是4HC1+O2
;(2)根据装置C中气泡溢出的速度可以判断并控制气体流速,氯化氢、氧气在装置C中能混合均匀;(3)装置E是球形干燥管;水能使硫酸铜变蓝,硫酸铜变蓝,可知装置D中氯化氢与氧气生成水和氯气,反应方程式是4HC1+O2![]() 2H2O+ 2C12;Ⅱ. E出来的气体含有氧气、氯气、氯化氢,通过K后氧气与碳反应生成CO,通过J中PdCl2溶液捕获CO后剩余氯气、二氧化碳;通过L进行干燥除水,通过干燥的红纸条证明干燥的Cl2无漂白性、通过湿润的红纸条证明湿润的Cl2有漂白性、通过装置J证明Cl的非金属性强于S,所以装置连接的合理顺序为E→G→K→J→L→H→F→I→尾气处理;(5)氯气与硫化钠溶液反应生成淡黄色硫沉淀,可以证明Cl的非金属性强于S,所以X的名称为硫化钠溶液;(6)PdCl2溶液捕获CO时,生成金属单质Pd和两种酸性气体化合物CO2、HCl,反应方程式是PdCl2+CO+H2O=Pd+CO2+2HCl。(7)将净化后的混合气体通入足量CCl4,再通入AgNO3溶液,无白色沉淀生成,则证明净化后的Cl2中不含HC1。
2H2O+ 2C12;Ⅱ. E出来的气体含有氧气、氯气、氯化氢,通过K后氧气与碳反应生成CO,通过J中PdCl2溶液捕获CO后剩余氯气、二氧化碳;通过L进行干燥除水,通过干燥的红纸条证明干燥的Cl2无漂白性、通过湿润的红纸条证明湿润的Cl2有漂白性、通过装置J证明Cl的非金属性强于S,所以装置连接的合理顺序为E→G→K→J→L→H→F→I→尾气处理;(5)氯气与硫化钠溶液反应生成淡黄色硫沉淀,可以证明Cl的非金属性强于S,所以X的名称为硫化钠溶液;(6)PdCl2溶液捕获CO时,生成金属单质Pd和两种酸性气体化合物CO2、HCl,反应方程式是PdCl2+CO+H2O=Pd+CO2+2HCl。(7)将净化后的混合气体通入足量CCl4,再通入AgNO3溶液,无白色沉淀生成,则证明净化后的Cl2中不含HC1。

【题目】现有部分短周期元素的性质或原子结构如表所示:
元素编号 | 元素性质或原子结构 |
X | 其简单离子在第3周期元素的简单离子中半径最小 |
Y | 其最简单氢化物丙的水溶液呈碱性 |
Z | 原子核外电子数和周期序数相等 |
A、B、D三种单质(单质分别由X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种火箭发动机的高能燃料,一个分子中含有18个电子,其组成元素与丙相同,戊是两性氢氧化物。
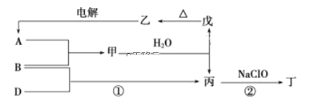
请回答:
(1)元素X在周期表中的位置是________,其简单离子的结构示意图为________。
(2)单质B电子式为________、丁电子式为________。
(3)丙中所包含的化学键类型有_______(填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,1 mol NaClO参加反应时,转移2 mol电子,其离子方程式为______________。
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。该化学方程式为____________________。