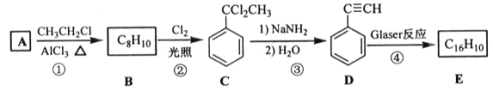
题目内容
【题目】下列关于水溶液中的离子平衡问题叙述正确的是( )
A.将10mL0.1mol·L-1盐酸加入到10mL0.1mol·L-1碳酸钠溶液中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
B.0.02mol·L-1HCN溶液与0.02mol·L-1NaCN溶液等体积混合:c(HCN)+c(CN-)=0.04mol·L-1
C.等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①=②>③>④
D.向0.01mol·L-1醋酸溶液中加水,稀释后溶液中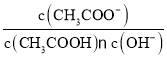 比值增大(忽略稀释过程中溶液温度变化)
比值增大(忽略稀释过程中溶液温度变化)
【答案】A
【解析】
A. 10mL0.1mol·L-1盐酸加入到10mL0.1mol·L-1碳酸钠溶液中,反应生成NaCl和NaHCO3,溶液呈碱性;
B. 根据物料守恒进行计算;
C. 等物质的量浓度的4种溶液①中Al3+抑制了NH4+的水解,②中NH4+的水解,③中CH3COO-水解促进了NH4+的水解,④中发生弱碱的电离,据此分析;
D.结合醋酸的电离平衡常数Ka和水的离子积Kw分析。
A. 10mL0.1mol·L-1盐酸加入到10mL0.1mol·L-1碳酸钠溶液中,反应生成NaCl和NaHCO3,溶液呈碱性,NaHCO3电离程度小于水解程度,所以离子浓度大小关系为:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-),A项正确;
B. 0.02mol·L-1HCN溶液与0.02mol·L-1NaCN溶液等体积混合,c(HCN)=c(NaCN)=0.01mol/L,根据物料守恒有c(HCN)+c(CN-)=2 c(Na+)=2×0.01mol/L=0.02mol/L,B项错误;
C. 等物质的量浓度的4种溶液①中Al3+抑制了NH4+的水解,②中NH4+的水解,③中CH3COO-水解促进了NH4+的水解,④中发生弱碱的电离,因而c(NH4+) 由大到小的顺序是①>②>③>④,C项错误;
D.醋酸溶液加水稀释后的溶液中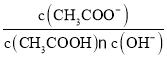 =
=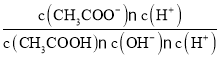 =
=![]() ,由于Ka和Kw都只与温度有关,所以,比值不变,D项错误;
,由于Ka和Kw都只与温度有关,所以,比值不变,D项错误;
答案选A。

【题目】如图,将乙针筒内的物质压到甲针筒内,进行下表所列实验,对实验现象的描述错误的是
(气体在同温同压下测定)
![]()
选项 | 甲针筒内物质 | 乙针筒内物质 | 甲针筒的现象 |
A | 20mLH2S | 10mLSO2 | 生成黄色固体,活塞自动向内压缩 |
B | 1g薄铜片 | 10mL12mol/L浓硝酸 | 生成棕色气体、溶液呈绿色,活塞自动外移,Cu有剩余 |
C | 30mLNO2 | 10mL水(液态) | 剩有无色气体,活塞自动向内压缩 |
D | 10mLFeSO4溶液 | 10mLNH3 | 生成白色沉淀,最终沉淀转变为红褐色 |
A.AB.BC.CD.D