题目内容
【题目】由短周期常见元素组成的纯净物甲、乙、丙、丁,其转化关系如下图所示,己知物质甲与物质乙之间的反应不在溶液中进行。

(1)若丙是淡黄色固体,其焰色反应为黄色,则化合物丙的化学式为____________;在常温下,向pH=a的醋酸溶液中加入等体积pH=b的丁溶液,且a+b=14,则充分反应后,所得溶液中各种离子的浓度由大到小的顺序是_______________________。
(2)若常温下丙是有色气体,丁是—元强酸。则化合物丙与H2O反应的化学方程式为__________________。
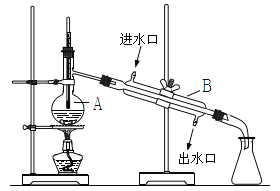
(3)某化学兴趣小组利用下图来探究(2)中气体丙的性质。

实验中,装置A中淡黄色固体变成白色固体,体现了气体丙的______________(填“氧化性,或“还原性”),一段时间后,装置B中溶液开始变蓝,写出溶液变蓝的离子方程式_____________________。
【答案】 Na2O2 c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 3NO2+H2O=2HNO3+NO 还原性 NO2+2I-+2H+=NO+I2+H2O
【解析】(1)若丙是淡黄色固体,其焰色反应为黄色,则丙为Na2O2,丁为NaOH溶液;在常温下,向pH=a的醋酸溶液中加入等体积pH=b的NaOH溶液,且a+b=14,因醋酸为弱酸,醋酸过量,反应后溶液呈酸性,则有c(H+)>c(OH-),根据溶液中的电荷守恒式c(Na+)+c(H+)=c(CH3COO-)+c(OH-),可知所得溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-);
(2)丙是有色气体,且丁为一元强酸,则丙应为NO2,甲应为O2,乙为NO,丁为HNO3,NO2与水反应生成HNO3和NO,反应的方程式为3NO2+H2O=2HNO3+NO;
(3)NO2通过淡黄色固体Na2O2后,固体变成白色固体,说明NO2变Na2O2氧化,体现气体NO2的还原性,多余的NO2气体通入酸性的淀粉KI溶液,一段时间后,溶液开始变蓝,说明有I2生成,发生反应的离子方程式为NO2+2I-+2H+=NO+I2+H2O。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案