题目内容
(8分)用价层电子对互斥理论判断下列物质的空间构型:
① NH4+ ② NH3
③ CCl4 ④ SO3
① NH4+ ② NH3
③ CCl4 ④ SO3
正四面体形 三角锥形 正四面体形 平面三角形
试题分析:价层电子对互斥理论认为,在一个共价分子中,中心原子周围电子对排布的几何构型主要决定于中心原子的价电子层中电子对的数目。所谓价层电子对包括成键的σ电子对和孤电子对。NH4+中不存在孤对电子,所以价层电子对是4对,因此是正四面体型结构;氨气中的孤对电子对数=(5-1×3)÷2=1对,所以氨气是三角锥形结构;四氯化碳中孤对电子对数=(4-1×4)÷2=0,所以是正四面体型结构;三氧化硫中心原子的孤对电子对数=(6-2×3)÷2=0,所以是平面三角形结构。
点评:该题是中等难度的试题,试题注重基础,侧重能力的培养和训练。该题的关键是准确判断出中心原子含有的孤对电子对数,然后结合题意灵活运用即可,有利于培养学生的抽象思维能力和逻辑思维能力。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
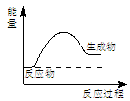
 2HI(g)
2HI(g)  H= —9.48 KJ/mol
H= —9.48 KJ/mol