题目内容
下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 , 可用于制半导体材料的元素是_______。(均填元素符号)
(2)最高价氧化物的水化物碱性最强的是 ,氢化物最稳定的是 ,呈两性的是 ;(均填化学式)
(3)在B、C、D、J、 E、F、G、H中,原子半径最大的是 。(填元素符号).
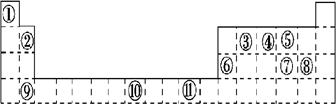
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | | ||||||
| 2 | | | | D | E | | G | |
| 3 | B | | C | J | F | | H | I |
(2)最高价氧化物的水化物碱性最强的是 ,氢化物最稳定的是 ,呈两性的是 ;(均填化学式)
(3)在B、C、D、J、 E、F、G、H中,原子半径最大的是 。(填元素符号).
(1)Ar、F 、Si (2)NaOH、HF、Al(OH)3 (3) Na
试题分析:根据元素在周期表中的相对位置可知,A~I元素分别是H、Na、Al、C、N、P、F、Cl、Ar、Si。
(1)同周期自左向右金属性逐渐减弱,同主族自上而下金属性逐渐增强,据此可知,A~I元素中,;化学性质最不活泼的是Ar。只有负价而无正价的是F,可用于制半导体材料的元素是Si。
(2)金属性或非金属性越强,则最高价氧化物的水化物的碱性或酸性越强,所以在A~I元素中,最高价氧化物水化物碱性最强的是NaOH,最高价氧化物水化物呈两性的是Al(OH)3。非金属性越强,氢化物的稳定性越强,则氢化物最稳定的是HF。
(3)同周期自左向右,原子半径逐渐增大,同主族自上而下原子半径逐渐减小,所以在B、C、D、J、 E、F、G、H中,原子半径最大的是Na。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
 其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。
其价电子排布式__________。第四周期中电子排布4s轨道上电子数与之相同的还有 元素(填元素符号)。