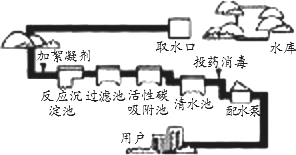
题目内容
NaClO是碱性条件下常用氧化剂,但NaClO(aq)的氧化性:酸性>中性>碱性。故人们用NaClO(aq)消毒时,常向NaClO(aq)中加些醋酸。(1)写出NaClO与CH3COOH反应的离子方程式:___________________________。
(2)NaClO(或HClO)氧化菌体细胞后的还原产物是什么?_________(写化学式)。
(3)NaClO(s)还能氧化浓盐酸为Cl2,写出其反应的化学方程式:_______________。
解析:(1)发生复分解反应,方程易得。离子方程式,CH3COOH、HClO都是弱酸,不可拆。
(2)NaClO(或HClO)中Cl元素的化合价为+1,被还原,化合价降低,降为0价还是降为-1价;显然是后者,因为即使降为0价,还原产物Cl2还是能与H2O作用生成HCl和HClO,得结果相当于NaClO(或HClO)转化为了HCl(或NaCl)。
(3)NaClO氧化HCl为Cl2,本身也被还原为Cl2:
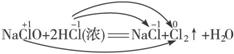
如果将稀NaClO(aq)与稀HCl(aq)混合;则发生下列反应:
NaClO+HCl![]() NaCl+HClO
NaCl+HClO
因为稀盐酸还原性弱,NaClO(aq)不能氧化稀盐酸。
答案:(1)ClO-+CH3COOH![]() CH3COO-+HClO
CH3COO-+HClO
(2)Cl-(或NaCl,或HCl)
(3)NaClO+2HCl(浓)![]() NaCl+Cl2↑+H2O
NaCl+Cl2↑+H2O

练习册系列答案
相关题目