题目内容
【题目】【化学——选修3:物质结构与性质】氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:

请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是_____________、____________________;
(2)基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4-的立体结构为_______;
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
【答案】 ![]()
![]() 1s22s22p1 N +3 120° sp2 正四面体 共价键(极性键) 分子间作用力
1s22s22p1 N +3 120° sp2 正四面体 共价键(极性键) 分子间作用力 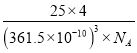
【解析】试题分析:(1)由流程图及元素守恒可写出这两个反应的方程式;
(2)B的原子序数为5,其基态原子的电子排布式为1s22s22p1;B和N都属于第二周期元素,同周期自左至右元素的电负性逐渐增大;B属于第ⅢA族元素,化合价为+3价.
(3)依据价层电子对互斥理论,计算出的孤对电子对数以及价层电子对数,可判断出分子的空间构型;
(4)B、N均属于非金属元素,二者形成的化学键是极性共价键;根据其结构与石墨相似,层与层之间应该靠分子间作用力结合.
(5)金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,所以金刚石的一个晶胞中含有的碳原子数=8×![]() +6×
+6×![]() +4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为
+4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为![]() ,一个立方氮化硼晶胞的体积是(361.5pm)3。
,一个立方氮化硼晶胞的体积是(361.5pm)3。
解析::(1)由图可知B2O3与CaF2和H2SO4反应即生成BF3,同时还应该产生硫酸钙和水,方程式为![]() ;B2O3与氨气在高温下反应即生成BN和水,方程式为
;B2O3与氨气在高温下反应即生成BN和水,方程式为![]() ;
;
(2)基态B原子的电子排布式为1s22s2sp1;B与N均位于第二周期,电负性从左向右依次递减,所以N的电负性大于B;BN中B元素的化合价为+3;
(3)依据价层电子对互斥理论,BF3的孤对电子对数=![]() (4-4×1)=0,并且价层电子对数为3,所以BF3分子为平面正三角形结构,键角为120°,杂化方式为sp2;BF4-中心原子的孤对电子对数=
(4-4×1)=0,并且价层电子对数为3,所以BF3分子为平面正三角形结构,键角为120°,杂化方式为sp2;BF4-中心原子的孤对电子对数=![]() (4-4×1)=0,其价层电子对数为4,所以其结构为正四面体;(4)B、N均属于非金属元素,二者形成的化学键是极性共价键;根据石墨结构可知六方氮化硼晶体中,层与层之间靠分子间作用力结合;(5)金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,所以金刚石的一个晶胞中含有的碳原子数=8×
(4-4×1)=0,其价层电子对数为4,所以其结构为正四面体;(4)B、N均属于非金属元素,二者形成的化学键是极性共价键;根据石墨结构可知六方氮化硼晶体中,层与层之间靠分子间作用力结合;(5)金刚石晶胞是立方体,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,所以金刚石的一个晶胞中含有的碳原子数=8×![]() +6×
+6×![]() +4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为
+4=8,因此立方氮化硼晶胞中应该含有4个N和4个B原子.一个晶胞中的质量为![]() ,一个立方氮化硼晶胞的体积是(361.5pm)3,密度是
,一个立方氮化硼晶胞的体积是(361.5pm)3,密度是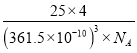 g·cm-3。
g·cm-3。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案